
- •Лекции по физической химии – 3 курс, I часть
- •Итак, теория Аррениуса сводится к трем основным положениям:
- •Термодинамическая теория растворов сильных электролитов
- •Активности и коэффициенты активности ионов
- •Числа переноса ионов
- •Первичная и вторичная сольватация
- •Формулы для расчета растворимости малорастворимых электролитов типа 1:1.
- •Электродные потенциалы. Эдс гальванических элементов
- •2. Химические гальванические элементы
- •2. Элементы с переносом
- •Элементы без переноса
- •2. Схема измерения,
- •2. Методы устранения диффузионного скачка потенциала
- •2. Определение констант равновесия химических реакций
- •3. Определение активностей и коэфф. Активностей эл-тов
- •4. Определение раствора
- •5. Определение малорастворимых соединений
2. Химические гальванические элементы
а) простые химические цепи, понятие (1 раствор)
1) элемент из водородного и хлорсеребряного электродов
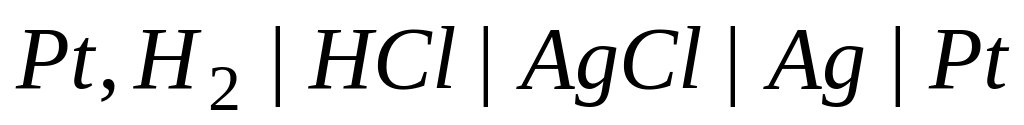
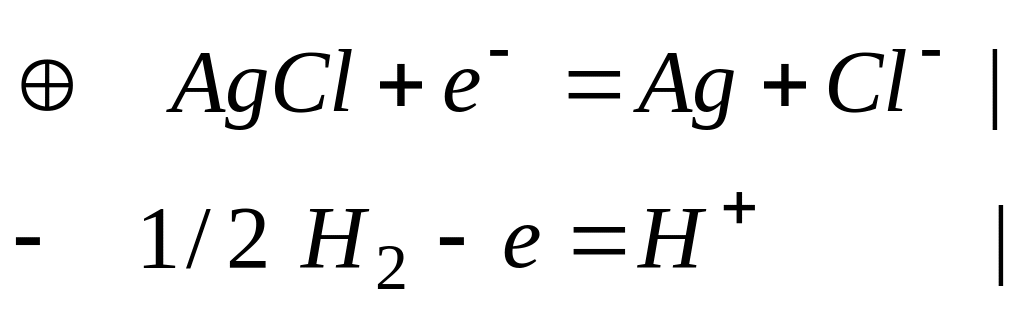
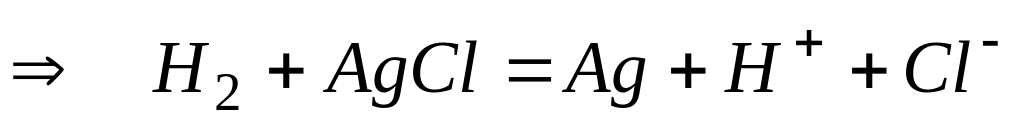
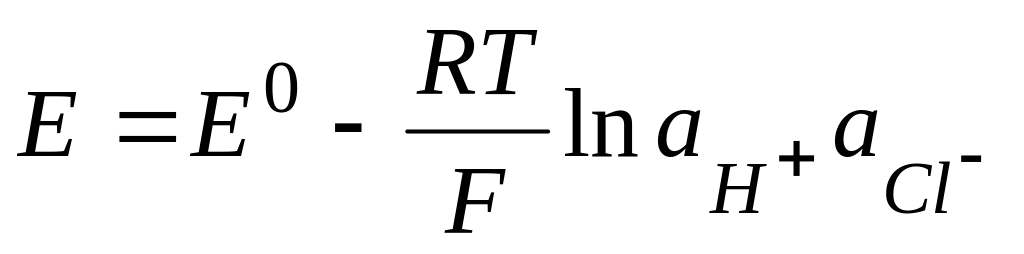
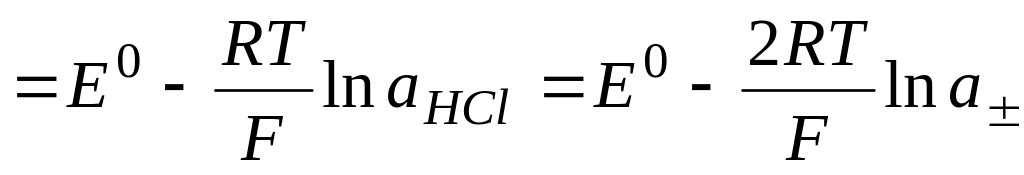
 2) пример –
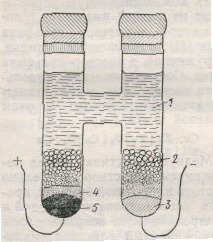
элемент Вестона
2) пример –
элемент Вестона
а) состав и устройство элемента Вестона,
б) условная запись эл-та и ур-ние реакции
![]() ,
,
![]()
в) применение элемента – источник стандартной ЭДС
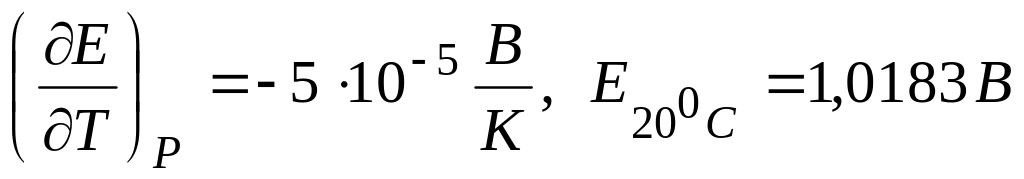
б) сложные химические элементы (2 раствора)
1) элемент Якоби-Даниэля,
2) вывод уравнения Нернста элемента Я-Д через
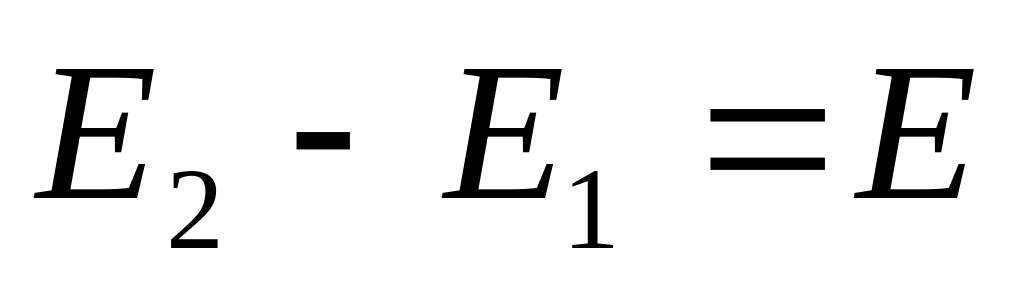
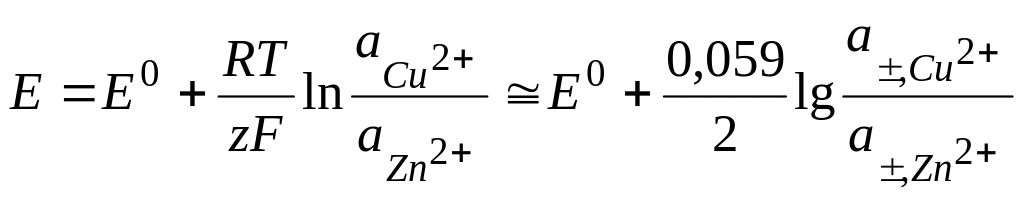
недостаток – наличие диффузионного потенциала
4) химический г.э. – хим. источник электрической энергии
Концентрационные гальванические элементы
1. Понятие, элементы с переносом и без переноса
2. Элементы с переносом
Концентрационными элементами с переносом наз. элементы, составленные из одинаковых по химической природе электродов, но с разными по концентрациям растворами электролитов, причем между р-рами имеется непосредственная граница соприкосновения
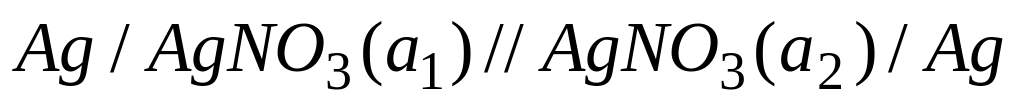 ,
,
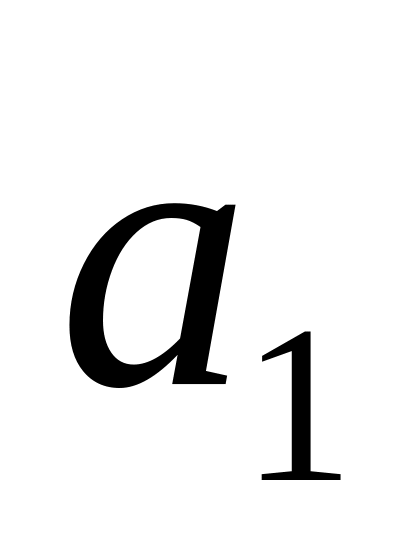
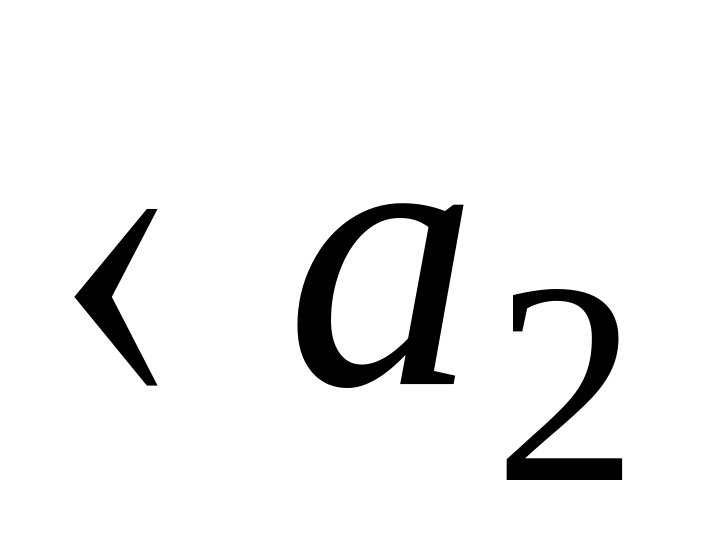
![]() ,
,
![]()
т.о. в ходе работы элемента происходит перенос потенциал-определяющих ионов из одного полуэлемента в другой и при выравнивании концентраций работа элемента прекращается
Элементы без переноса
1) амальгамные,
![]() где
где
![]()
![]()
![]() ,
,
![]()
2) газовые,
![]()
![]()
3) эл. цепь из двух хим. элементов с одним раствором электролита, включенных навстречу друг другу
![]()
+
![]()
![]()
![]()
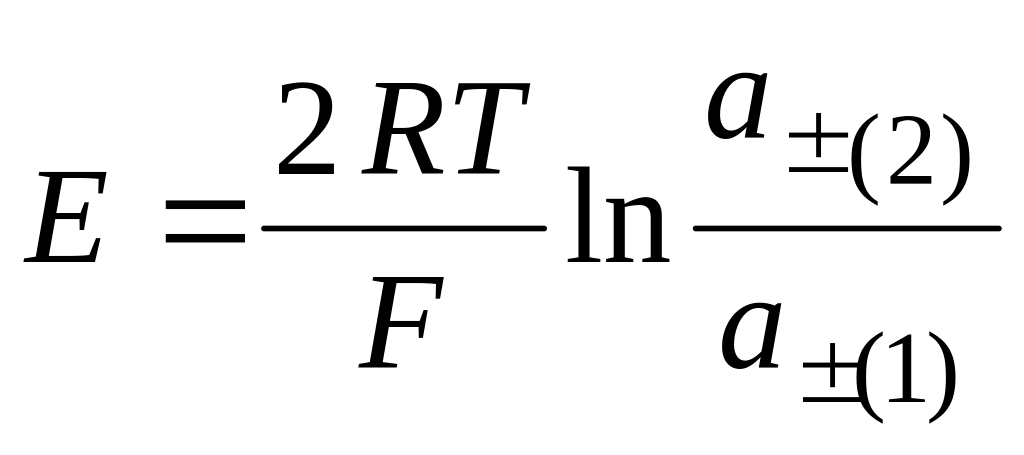
Методика измерения ЭДС и электродных потенциалов
1. Принцип компенсационного метода Поггендорфа (1848)
2. Схема измерения,
3. Расчет ЭДС:
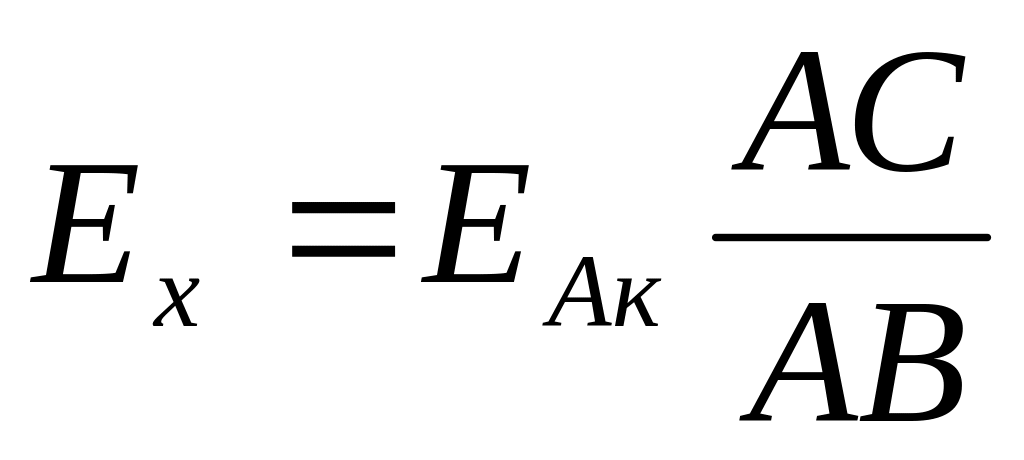 ,
,
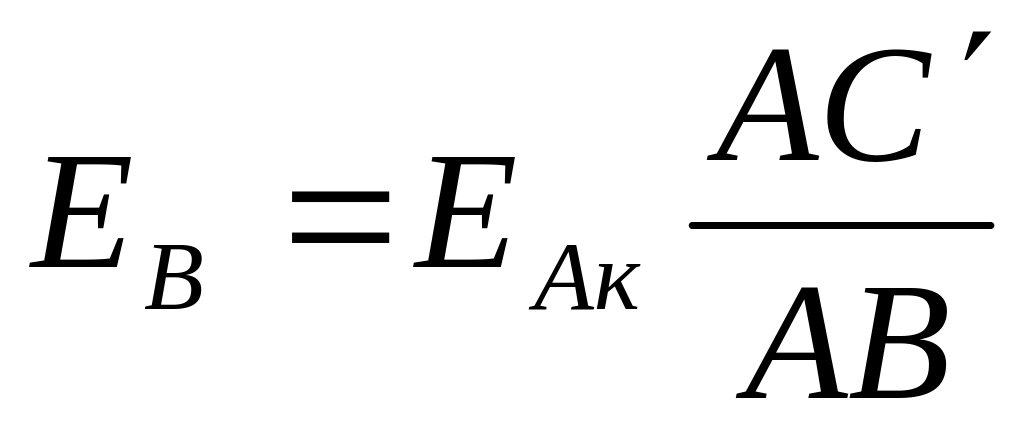
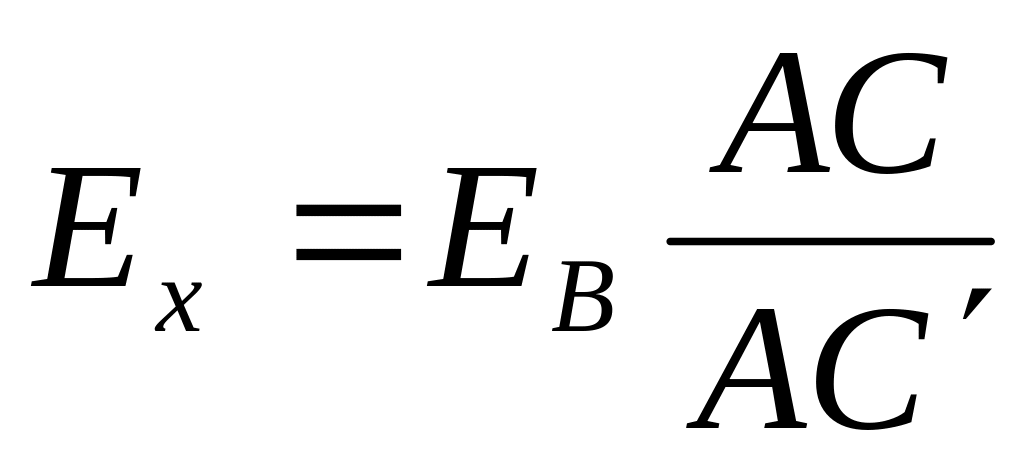 ,
где
,
где

Диффузионный потенциал и механизм его возникновения
1.Природа возникновения потенциала в :
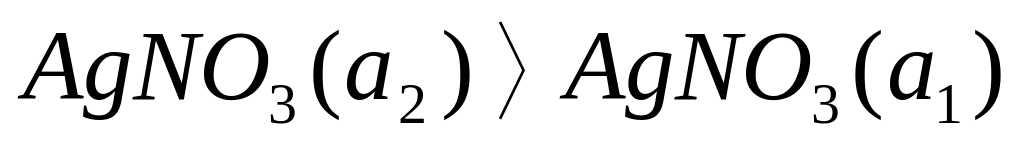
а) Схема:
![]()
б) Образование
ДЭС на границе раздела фаз из-за
![]()
в) установление
стац-ного режима переноса ионов:
![]()
г)
![]() не явл. т/д величиной, но стационарной
(
не явл. т/д величиной, но стационарной
(![]() )
)
г) уравнение
Гендерсона-Планка (1907) для 1-1-ного
электролита:
![]()
![]()
![]()
2. Методы устранения диффузионного скачка потенциала
а) солевой мостик, принцип действия – 2 противоположно направленных скачка потенциала, компенсирующих друг друга
б) введение в контактирующие р-ры индифферентного эл-та
в) элементы с одним эл-том
Зависимость ЭДС гальванического эл-та от температуры
1. Уравнение, определяющее зависимость
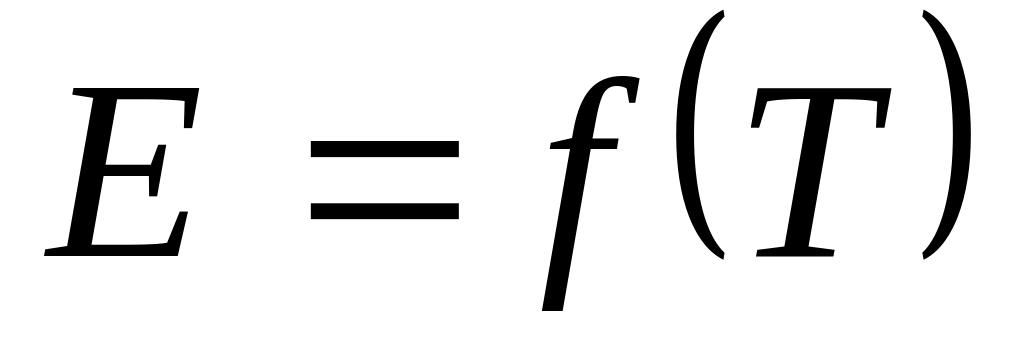
а)
![]()
![]()
![]() ,
,
![]()
б) анализ:
![]() ,
,
![]() ,
,
![]()
2. Электрохимическая форма основного уравнения т-ки
![]() ,
где
,
где
![]()
3. Анализ работы гальванического элемента
а)
![]()
![]()
![]() ,
,
![]()
б)
![]()
![]()
![]()
![]() ,
,
![]()
в)
![]()
![]() ,
,
![]()
1)
![]()
![]()
![]()
2)
![]()
![]()
![]()
3)
![]()
![]()
Влияние давления на ЭДС гальванического элемента
1.
![]()
![]()
![]()
![]()
б)
![]() .
Величина
.
Величина
![]()
Применение измерений ЭДC
1. Расчет т/д функций химических реакций, протекающих в г.э.
![]()
![]()
