
- •Лекции по физической химии – 3 курс, I часть
- •Итак, теория Аррениуса сводится к трем основным положениям:
- •Термодинамическая теория растворов сильных электролитов
- •Активности и коэффициенты активности ионов
- •Числа переноса ионов
- •Первичная и вторичная сольватация
- •Формулы для расчета растворимости малорастворимых электролитов типа 1:1.
- •Электродные потенциалы. Эдс гальванических элементов
- •2. Химические гальванические элементы
- •2. Элементы с переносом
- •Элементы без переноса
- •2. Схема измерения,
- •2. Методы устранения диффузионного скачка потенциала
- •2. Определение констант равновесия химических реакций
- •3. Определение активностей и коэфф. Активностей эл-тов
- •4. Определение раствора
- •5. Определение малорастворимых соединений
Итак, теория Аррениуса сводится к трем основным положениям:
1. При растворении молекулы вещества могут самопроизвольно распадаться (диссоциировать) на ионы. Ионы представляют собой заряженные частицы, которые состоят или из отдельных атомов, или из группы атомов. Например: NaС1 = Na+ + С1- , CH3COOH = CH3COO- + Н+.
2. Диссоциация молекул на ионы в общем случае является неполной. В растворах слабых электролитов на ионы могут распадаться не все молекулы вещества, а лишь некоторая их доля α , названная степенью диссоциации.
3. Электролитическая диссоциация слабых электролитов подчиняется закону действующих масс. Использование этого закона создает основу для количественных расчетов равновесий в слабых электролитах.
Недостатки теории Аррениуса.
Физические причины, которые приводят к диссоциации электролитов, в теории Аррениуса не рассматриваются. Предполагается, что ионы в растворе ведут себя подобно молекулам идеального газа, т. е. не взаимодействуют друг с другом. Не обсуждался также и вопрос о том, почему заряженные частицы, на которые должны были бы распространяться законы электростатики, не взаимодействуют друг с другом в растворах. Позднее пришлось пересмотреть и некоторые количественные выводы из теории Аррениуса в ее первоначальной форме. Возникла необходимость внести поправки при описании свойств концентрированных растворов слабых электролитов. Вместе с тем, самые основы теории остались неизменными.
Теория Аррениуса наиболее точно выполняется в присутствии избытка постороннего электролита (фона), не принимающего участия в изучаемых ионных равновесиях. Это показывает, что основной причиной неточного выполнения положений теории является взаимодействие ионов друг с другом и с молекулами растворителя.
Для сильных электролитов процесс диссоциации является полным, и закон действующих масс неприменим. Попытки Аррениуса найти следы недиссоциированных молекул в сильных электролитах и использовать свою теорию для описания их свойств оказались безуспешными.
Термодинамическая теория растворов сильных электролитов
Растворы электролитов содержат ионы – заряженные частицы, которые взаимодействуют как между собой (ион-ионное взаимодействие), так и с молекулами растворителя (сольватация, гидратация). Поэтому в растворах электролитов наблюдаются более значительные отклонения от идеальности, чем в растворах неэлектролитов той же концентрации. Для них необходимо вводить понятия активности и коэффициентов активности.
Активности и коэффициенты активности ионов
1. Формальный прием согласования опытных данных с рассчитываемыми - введение вместо концентрации с в соответствующие соотношения для идеальных растворов – активности а = γс, где γ – коэффициент активности.
2. Термодинамическая константа равновесия: вместо K = c+c-/cKA
![]()
Особенно большие отклонения от свойств идеальных растворов наблюдаются для растворов сильных электролитов вследствие их полной диссоциации на ионы.
Связь активности электролита с активностями ионов
![]()
1. В соответствии с принципом электронейтральности

2. Выражения для химического потенциала электролита в целом и отдельных ионов
а) для электролита
![]() ,
,
![]() хим. потенциал 2го
компонента в стандартном состоянии
(2-м компонентом считается растворенное
вещество, 1-й компонент – растворитель).
хим. потенциал 2го
компонента в стандартном состоянии
(2-м компонентом считается растворенное
вещество, 1-й компонент – растворитель).
Стандартное состояние – некоторое гипотетическое состояние 2го компонента компонента в одномоляльном растворе, в котором он сохраняет те же свойства, что и в предельно разбавленном растворе.
![]() ,
реально
,
реально![]()
![]() ,
,
![]() - практический (моляльный) коэффициент
активности
- практический (моляльный) коэффициент
активности
б) для ионов
![]()
![]()
3. Подставляя данные соотношения в уравнение п.1, имеем:
![]()
![]()
![]()
Раскрывая скобки, получаем
![]()
![]()
В стандартном состоянии
![]()
6.
Тогда
![]()
![]()
![]() ,
откуда (после потенцирования):
,
откуда (после потенцирования):
![]()
Индивидуальные
![]() и средние ионные активности
и средние ионные активности
![]()
и
коэффициенты активностей
![]() .
.
1. Индивидуальные и средние ионные активности . Связь.
Условно принимают, что:

![]()
![]()
![]() ,
где
,
где
![]()
![]()
![]() -
экспериментально определяемая величина.
-
экспериментально определяемая величина.
2.
Средняя ионная активность
![]()
3. Связь активностей, моляльностей и коэффициентов активности
![]() ,
где
,
где
![]()
![]()
![]() ,
,
![]() .
.
4.
Принцип определения
и
![]() :
:
![]() .
.
5. Пример:
 ,
,
 ,
,
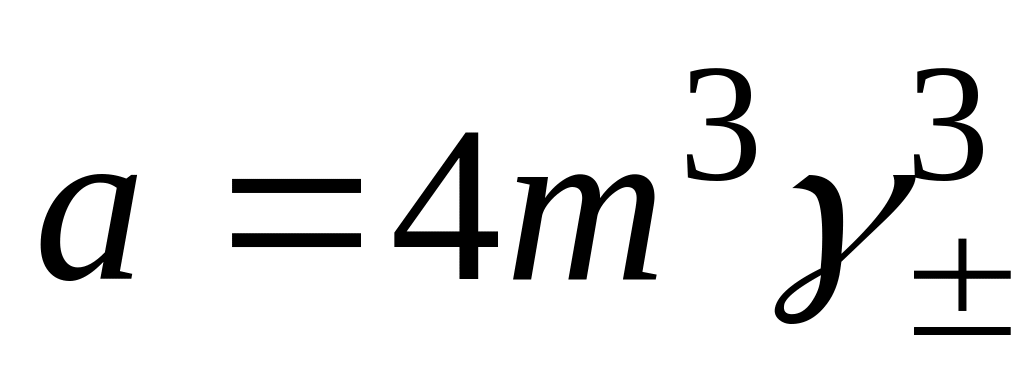
Экспериментальные величины коэффициентов активностей
электролитов. Правило ионной силы.
Независимость
 от природы электролита в пределах
данного валентного типа в разбавл.
растворах
от природы электролита в пределах
данного валентного типа в разбавл.
растворах
Зависимость
![]() для электролитов типа 1-1
для электролитов типа 1-1![]() .
.
 .
Суммарное влияние смеси электролитов
на коэффициент активности каждого из
присутствующих в растворе ионов
определяется величиной ионной силы
раствора:
.
Суммарное влияние смеси электролитов
на коэффициент активности каждого из
присутствующих в растворе ионов
определяется величиной ионной силы
раствора:
 .
.
![]() - мера электростатического
взаимодействия между всеми ионами
раствора
- мера электростатического
взаимодействия между всеми ионами
раствора
Правило «ионной силы»
 ,
,
 .
.
В разбавленных растворах средний коэффициент активности электролита зависит лишь от величины ионной силы раствора и не зависит от природы других ионов, находящихся в растворе
Теория сильных электролитов Дебая и Хюккеля (1923г.)
Задача – теоретический расчет коэффициента активности.
Исходные положения: полная диссоциация, отклонения от идеальности связаны с электростатическим взаимодействиями между ионами, последние рассматриваются как взаимодействия между ионом и ионной атмосферой.
Реальная ионная атмосфера – статистическое, динамическое образование из ионов, возникающее в р-ре вокруг центрального иона.
а) распределение ионов вокруг центрального иона (силы эл.-ст. взаим-я и тепловое движение).
б) избыточная плотность зарядов противоположного знака,
в) каждый ион является одновременно и центральным ионом и входит в состав ионной атмосферы сферы других ионов.
4. Условная ионная атмосфера - равномерно заряженная сфера определенного радиуса, оказывающая на ц. ион такое же воздействие, что и реальная ионная атмосфера
(![]() ).
).
5. Уравнение для электрического потенциала ионной атмосферы.
а) Потенциал эл. поля в любой точке пространства вокруг ц. иона:
![]() .
.
б) Потенциал ц. иона по законам электростатики:
![]() ,
где
,
где
![]() -
расстояние от центрального иона
-
расстояние от центрального иона
в) Суммарный потенциал внутри условной ионной атмосферы – функция плотности эл. заряда в данной точке.
уравнение Пуассона:
 ,
где
,
где
 оператор
Лапласа,
оператор
Лапласа,решение уравнения:
 ,
,
![]()
6. Радиус ионной атмосферы.
а) Потенциал ионной атмосферы:

б) Радиус ионной атмосферы:
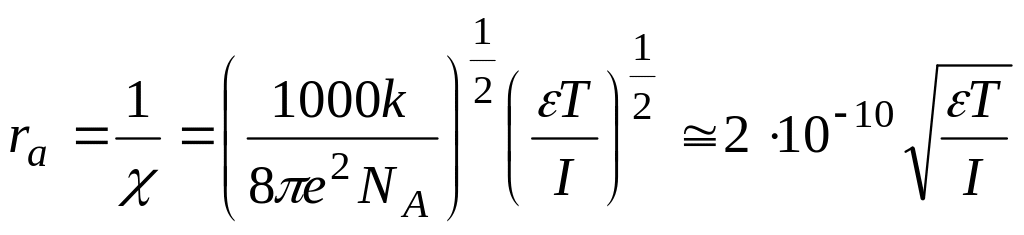
![]()
Связь индивидуальных и средних ионных коэффициентов активности с ионной силой раствора.
а) Энергия эл.-ст. взаимодействия ц. иона с ионной атмосферой.
![]() ;
;
на
1 моль:
![]()
б)
![]()
в) Химическая работа как переход из неид. в идеальное состояние
![]()
![]()
![]()
г) Связь и . Предельный закон Дебая-Хюккеля.
 ,
,
 ,
где
,
где
 .
.
Сопоставление теории Дебая-Хюккеля с экспериментом.
Закон Д.-Х. - теоретическое обоснование правила “ионной силы”.
Теоретические и экспериментальные зависимости
 .
.Область применения закона Дебая-Хюккеля
 .
.
Причины отклонений от закона Дебая-Хюккеля.
Допущения в исходных положениях теории (учет только эл.-ст.
взаимодействий, условная ионная атмосфера, отождествление ионов с точечными зарядами, пренебрежение ион-дипольными вза-
имодействиями)
Допущения и упрощения при выводе уравнения (диэлектрическая проницаемость, непрерывность распределения зарядов, разложе-ния в ряд и т.д.).
Закон независимого движения ионов. Подвижности ионов.
1. Сила тока через сечение
 определяется:
определяется:

 2.
Схема, поясняющая механизм переноса
эл. nока
2.
Схема, поясняющая механизм переноса
эл. nока
3.
Подсчет тока, переносимого катионами
и анионами,
![]()
![]()
![]()
![]() ,
,
![]()
4. Переход к молярной концентрации
![]() ,
,
![]()
![]()
5. Переход к эквивалентной концентрации
![]()
![]() ,
,
6.
Для
эл-та 1:1 имеем:
![]()
![]()
7. Выражение для æ и λ
![]() ,
,
![]() æ
æ![]() ,
,
![]()
λ
![]() ,
,
8. Подвижности ионов
![]()
слабые:
λ =
![]() (λ++λ-)
,
(λ++λ-)
,
сильные: λ = λ++λ-
9. Закон независимого движения ионов (Кольрауш, 1886г.)
 ,
при
,
при
 ,
где
,
где

10. Коэффициент электрической проводимости
 , где
, где

11. Разбавленные растворы
![]() .
.
![]()
Подвижности ионов
1.
Предельные
подвижности
(молярные
эл-ности) ионов,
![]()
![]()
![]() ,
,
![]()
![]()
 Эстафетный
механизм переноса эл-ности ионами
Эстафетный
механизм переноса эл-ности ионами

а )
+
)
+
![]()
![]() _
_

![]()
б)
![]()
