
- •Лекции по физической химии – 3 курс, I часть
- •Итак, теория Аррениуса сводится к трем основным положениям:
- •Термодинамическая теория растворов сильных электролитов
- •Активности и коэффициенты активности ионов
- •Числа переноса ионов
- •Первичная и вторичная сольватация
- •Формулы для расчета растворимости малорастворимых электролитов типа 1:1.
- •Электродные потенциалы. Эдс гальванических элементов
- •2. Химические гальванические элементы
- •2. Элементы с переносом
- •Элементы без переноса
- •2. Схема измерения,
- •2. Методы устранения диффузионного скачка потенциала
- •2. Определение констант равновесия химических реакций
- •3. Определение активностей и коэфф. Активностей эл-тов
- •4. Определение раствора
- •5. Определение малорастворимых соединений
Числа переноса ионов
1.
Определение:
![]() .
.
2.
Связь
![]()
а)
![]() ,
,
![]()
б)
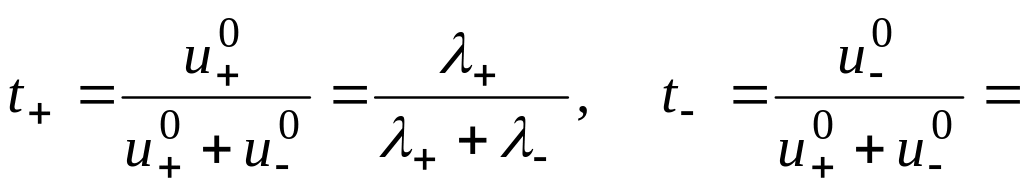
![]()
3. Связь между числами переноса ионов
 ,
,
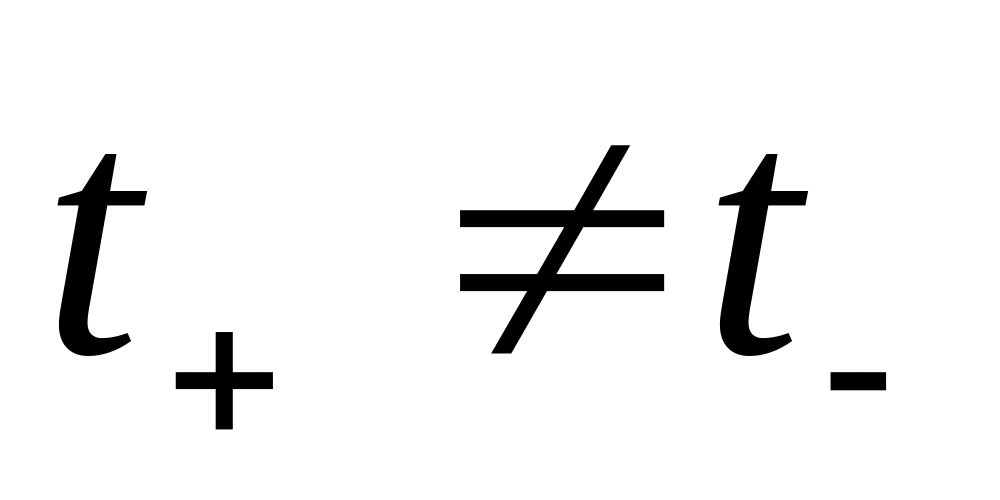 .
.
Применение измерений электропроводности для определения термодинамических свойств растворов электролитов
1.
Расчет
и
![]()
а)
![]() ,
,
![]()
![]()
б)
графический метод,
![]()
![]()
2. Термодинамика электролитической диссоциации
а)
![]()
б)
![]() 1)
1)
![]()
2)
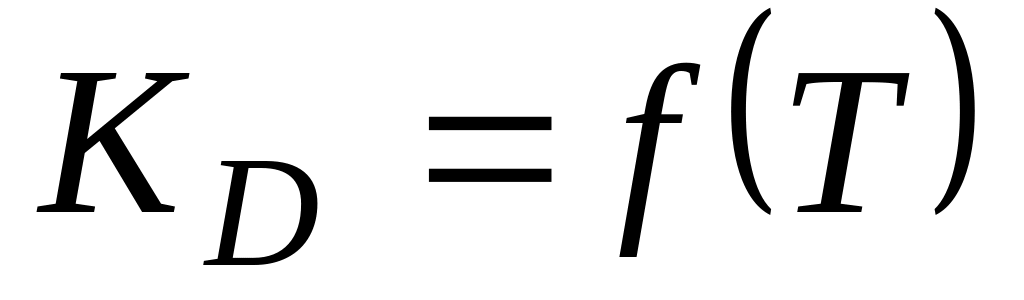 проходит через max
проходит через max
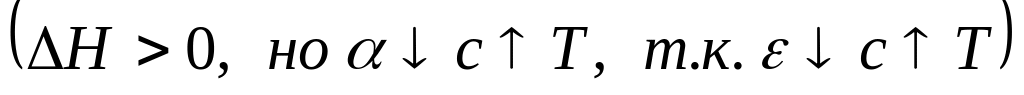
в)
расчет
![]() ,
,
![]()
3.
Определение
![]() раствора
раствора
![]() ,
,
![]() ,
,
![]()
4. Определение растворимости малорастворимых соединений
![]() ,
где
,
где
![]()
5. Кондуктометрическое титрование
а)
cущность метода – определение точки
эквивалентности по зависимости
![]()
б)
пример титрования кислоты щелочью:
![]()
1)
до точки эквивалентности:
![]()
2) после точки эквивалентности:

3) практически
линейная зависимость
![]() ,
т.к.
,
т.к.
![]()
4) достоинства и ограничения метода
а)
окрашенные соединения, чувствительность
![]()
б)
ограничение – различие в величинах
![]()
Дальнейшее развитие теории Дебая-Хюккеля.
Второе приближение теории – учет размеров ионов ( до
 ).
).
![]() ,
,
![]()
Третье приближение теории – учет
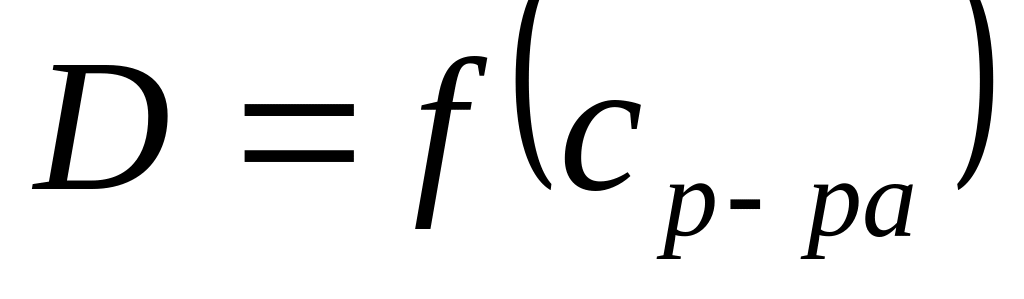 (до
(до
 ).
).
![]() ,
,
![]() эмпирическая
константа
эмпирическая
константа
Электропроводность растворов сильных электролитов.
Снижение электропроводности с ростом концентрации
 - следствие
- следствие
уменьшения подвижности ионов из-за наличия ионной атмосферы.
Электрофоретический эффект торможения
 .
.
а) Движение в неподвижном и «подвижном» растворителе.
б) Увеличение силы внутреннего трения во встречном потоке растворителя.
б) Увеличение тормозящего эффекта с ростом концентрации.
Релаксационный (асиметричный) эффект торможения
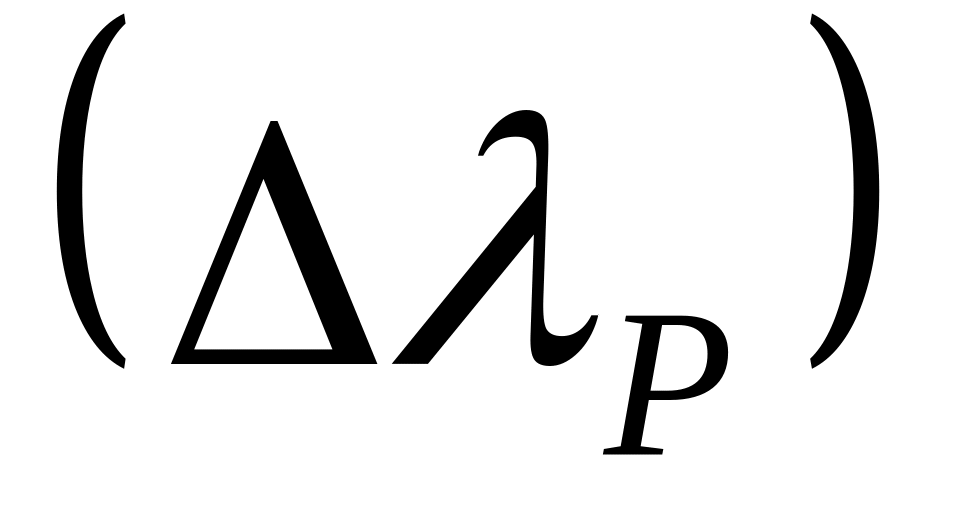 .
.
а) Разрушение-создание ионной атмосферы при движении ионов.
б) Нарушение симметрии ионной атмосферы – за центральным ионом возни-
кает «хвост» из ионов противоположного знака (схема).
в)
Время релаксации:
![]() , где
, где
![]() концентрация
эл-та.
концентрация
эл-та.
Суммарный эффект снижения электропроводности:
![]() .
.
Уравнение (теоретическое) Онзагера.
а)
Для электролитов типа 1:1 на основании
представлений о статистической природе
ионной атмосферы
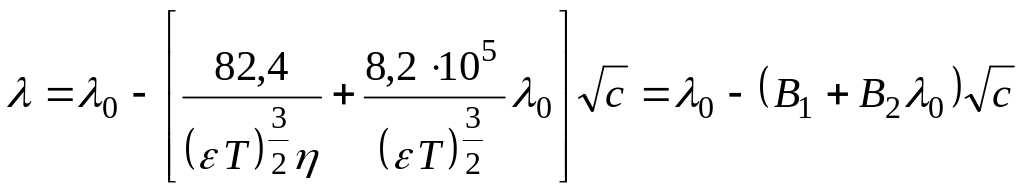
б) Теоретическая оценка вкладов электростатического и релакса-
ционного торможения в снижение электропроводности.
![]()
![]()
Эффекты электропроводности в электрических полях
высокой напряженности и высокой частоты.
1. Эффект Вина (1927) – 200000-400000 В/см.
а)
характер изменения зависимости
![]() ,
,
б)
![]() ,
т.к.
,
т.к.
![]() .
.
2. Эффект Дебая-Фалькенхагена.
а) предсказание эффекта полей высокой частоты,
б)
частота поля
![]() :
:
![]() ,
т.к.
,
т.к.
![]() ,
,
в)
![]()
Аномальная электропроводность. Ассоциация ионов.
Характер зависимости электропроводности р-ров электролитов в
растворителях с малой диэлектрической проницаемостью.
Объяснение – образование ассоциатов:
![]()
Причины ассоциации - превалирование сил эл.-ст. взаимодействия
над энергией теплового движения ионов (Семенченко, Бьеррум):
![]()
Отличие ионных пар от сольватированных молекул.
Константа диссоциации ионных пар (Семенченко).
![]()
Сольватация (гидратация) ионов
Сольватация (гидратация) – процесс образования достаточно прочной конфигурации каждого иона с определенным числом дипольных молекул растворителя в результате эл.-ст. вз-вия
![]()
![]() ,
,
![]()
![]()
