
Тема 3. Рецепторы биологических мембран
1. Общая характеристика лиганд-рецепторных взаимодействий
2. Рецепторы-ионные каналы
3. Рецепторы с тирозинкиназной активностью
4. Рецепторы, сопряженные с G-белками
1. Общая характеристика лиганд-рецепторных взаимодействий
Восприятие клетками внешних сигналов происходит, в основном, благодаря взаимодействию некоторых факторов (стимулов, лигандов) с определенными рецепторами, расположенными на поверхностной мембране клеток. Несмотря на огромное разнообразие стимулов и рецепторов существует всего несколько универсальных сигнальных систем, передающих информацию различным клеточным органеллам и запускающих определенные физиологические процессы в клетке.
Лигандом называют молекулу, которая может взаимодействовать с участком связывания молекулярного рецептора – специфическим участком молекулы, в основном, белковой природы, встроенной в мембрану клетки (мембранные рецепторы) или находящимся в цитоплазме.
При этом возможно два механизма связывания:
электрическое притяжение между противоположно заряженными ионными или полярными группами лиганда и участка связывания в белке
слабое притяжение, обусловленное ван-дер-ваальсовыми силами между неполярными областями двух молекул.
Белок – молекулярный рецептор может содержать несколько участков связывания, каждый из которых специфичен в отношении определенного лиганда.
Взаимодействие лиганда и участка связывания молекулярного рецептора лежит в основе реализации множества функций как самих белков, так и клеток в целом. Для реализации подобного механизма связывания необходимо, чтобы лиганд находился практически рядом с участком связывания белка. В противном случае сила электрического притяжения между противоположно заряженными областями на участке связывания молекулярного рецептора и лиганда будет мала. Эта сила значительно уменьшается по мере увеличения расстояния между молекулярным рецептором и Лигандом. Например, ван-дер-ваальсовы силы действуют только между неполярными группами, расположенными очень близко друг к другу. Эта близость достигается тем, что форма лиганда комплиментарна форме участка связывания, т.е. лиганд подходит к участку связывания как ключ к замку.
Взаимодействие лиганда с участком связывания молекулярного рецептора может быть строго специфичным, и, следовательно, участок связывания может связывать только один тип лиганда. Такая способность носит название химической специфичности. В то же время, другие участки связывания могут быть менее специфичными и способны связывать ряд родственных лигандов, если фрагмент таких лигандов комплиментарен форме участка связывания. По этому принципу выделяют следующие типы участков связывания:
с высоким сродством к лиганду
с промежуточным сродством
низким сродством
Силу связывания лиганда с участком связывания белка называют аффинностью или сродством. В зависимости от того, с позиции лиганда или участка связывания описывают аффинность, говорят либо об аффинности лиганда по отношению к участку связывания, либо об аффинности участка связывания по отношению к лиганду. В общем случае говорят об аффинности лиганд-рецепторного взаимодействия.
Аффинность лиганда по отношению к участку связывания определяет, насколько вероятно то, что связанный лиганд покинет поверхность белка и вернется в несвязанное состояние.
Другим фактором, определяющим процент насыщения участков связывания, является аффинность участка связывания по отношению к лиганду (в отличие от аффинности лиганда по отношению к участку связывания).
Таким образом, участок связывания, который прочно связывает лиганд, называют участком связывания с высоким сродством (или высокоаффинным участком), а тот участок, с которым лиганд связывается слабо – участком связывания с низким сродством (или низкоаффинным участком). Кроме того, известны участки связывания с промежуточной аффинностью.
Обычные столкновения между молекулами, находящимися в растворе, и рецептором, содержащим связанный лиганд, могут привести к вытеснению непрочно связанного лиганда. Мерой сродства участка связывания к лиганду служит концентрация лиганда, необходимая для обеспечения 50% насыщения. При этом, чем более низкая концентрация лиганда необходима для связывания его с половиной центров связывания, тем больше аффинность участка связывания к лиганду.
Аффинность и химическая специфичность представляют собой два основных свойства участков связывания. Химическая специфичность зависит от формы участка связывания, а аффинность – от силы притяжения между рецептором и лигандом.
Между лигандами, находящимися в растворе, и соответствующими участками связывания белка быстро достигается равновесие, так что в любой момент некоторые свободные лиганды становятся связанными со свободными участками связывания. Для описания этой ситуации применяют понятие насыщения (сатурации), определяющее совокупность участков связывания, содержащих связанный лиганд в данный момент времени. Когда заполнены все участки связывания, говорят о 100% насыщении. Когда лиганд связан с половиной имеющихся участков связывания, система насыщена на 50% и т.д.
Процент насыщения участков связывания зависит и от концентрации свободного лиганда, и от аффинности участка связывания к лиганду. И, как и степень выраженности биологического эффекта, он (процент насыщения) будет увеличиваться с увеличением количества занятых лигандом участков связывания до тех пор, пока все они не будут заполнены. Дальнейшее увеличение концентрации лиганда не приведет ни к какому результату, поскольку все участки связывания уже заняты.
Лиганды могу быть агонистами или антагонистами.
Агонист – это лиганд, который взаимодействует с участком связывания и изменяет состояние молекулярного рецептора, заканчивающееся биологическим эффектом. Например, в химическом синапсе агонистами называют вещества, действующие подобно трансмиттеру. Обычные (классические) агонисты усиливают активность рецептора, тогда как обратные агонисты – ее тормозят.
Наряду с агонистами существуют химические соединения, которые хотя и взаимодействуют с участком связывания на макромолекуле рецептора, но не могут открыть, например, ионный канал. Занимая участок связывания, они препятствуют рецепции естественного лиганда и возникновению его эффекта, поскольку действуют на одну и ту же самую макромолекулу рецептора, что и агонист. Такие вещества называют антагонистами.
Гормоны связываются с рецепторами высокоспецифичным образом и с высокой аффинностью (силой связывания). Связыванию гормона с рецептором осуществляется за счет ионных, ван-дер-ваальсовых и гидрофобных взаимодействий.
Д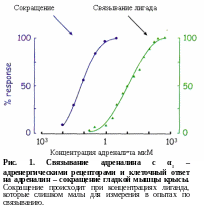 ля
многих рецепторов, взаимодействующих
с гормонами, концентрация лиганда,
необходимого для генерации максимального
клеточного ответа, меньше значения,
необходимого для насыщения всех
рецепторных молекул клетки (рис.1).
ля
многих рецепторов, взаимодействующих
с гормонами, концентрация лиганда,
необходимого для генерации максимального
клеточного ответа, меньше значения,
необходимого для насыщения всех
рецепторных молекул клетки (рис.1).
Рецепторы, взаимодействующие с гормонами, трудно идентифицировать и очистить, главным образом из-за того, что их относительное содержание очень мало. Поверхность типичной клетки содержит 10000 – 20000 рецепторов к отдельному гормону, что соответствует ≈10−6 от общего белка клетки или ≈10−4 от белка плазматической мембраны.
