
VI. Межмолекулярное отталкивание
Оно обусловлено отталкиванием атомных ядер разных молекул и отталкиванием внутренних электронов. Энергия отталкивания равна
![]() ,
,
где k − постоянная отталкивания, а n принимает целочисленные значения (для ионных кристаллов n = 5÷12).
Энергия притяжения равна
![]() ,
,
где a − постоянная притяжения; m = 2 − для ионного взаимодействия, m = 6 − для взаимодействия «мгновенный диполь − наведенный диполь» и т.д.
Энергия всех видов притяжения и межмолекулярного отталкивания называется энергией межмолекулярного взаимодействия по Ван-дер-Ваальсу Eм.в.:
![]() ;
;
Eм.в. = Ек + Ед + Ел + Еотт.
При m
= 6 и n
=12 имеем
![]() − функция
Леннарда-Дсонса,
называемая
− функция
Леннарда-Дсонса,
называемая
![]() -функцией.
-функцией.
Ван-дер-Ваальсовы силы отличаются от ковалентных сил отсутствием направленности и насыщаемости и проявляются на значительно больших расстояниях.
Металлическая связь
Имеет место в металлических кристаллах. Металлы имеют кристаллическое строение: в узлах расположены катионы Me, а в междоузлии — валентные (внешние) электроны. Этих электронов у s-металлов 1-2, у d-металлов — 2, у p-металлов (Sn, Pb) может быть до 4. Высокая электропроводность, теплопроводность, пластичность Me обусловлена наличием этих валентных электронов, которые не фиксируются между двумя атомами (как в случае образования ковалентной связи) и свободно мигрируют от атома к атому и поэтому могут принадлежать одновременно всем атомам данного кристалла. Их называют электронами проводимости {свободными электронами или электронным газом).
Электронный газ прочно связывает в кристалле атомные остовы (положительные ионы Me в узлах). Такой вид связи называется металлической связью.
Между ковалентной и металлической связью имеется сходство: оба типа связи основаны на обобществлении валентных электронов (обобществленные валентные электроны у Me, т.е. их совокупность, и представляет собой электронный газ). Сходство между ковалентной и металлической связями подтверждается распределением электронной плотности между атомными остовами: и там, и там межу остовами сохраняется значительная электронная плотность, образуя электронные мостики между взаимодействующими атомами. Отличие состоит в том, что в ковалентной связи эти мостики имеют строгое направление, а у металлической связи − электронная плотность распределена по всем направлениям.
В металлах обобществленные электроны обслуживают весь кристалл, т.е. они полностью делокализованы (рассредоточены по всему кристаллу в междоузлиях).
Этим объясняется:
отсутствие пространственной направленности металлической связи, т.е. ее ненаправленность и нелокализованность;
высокие координационные числа металлических структур (координационное число — число ближайших соседей вокруг данной частицы);
отсутствие свойств насыщаемости, т.е. ненасышенность.
Таким образом, металлическая связь — это многоцентровая химическая связь с дефицитом электронов в твердом или жидком веществе, основанная на обобществлении электронов атомов.
В паро- и газообразном состоянии атомы металлов связаны между собой ковалентной связью или вообще не связаны, но не металлической связью.
Метод валентных связей не может интерпретировать металлическую связь, т.к. в металлах с высокими координационными числами наблюдается сильный недостаток валентных электронов.
С точки зрения метода молекулярных орбиталей металлическая связь, характеризующаяся дефицитом электронов против нормальной ковалентной связи, может иметь любой дробный порядок связи (кратность связи). Из-за этого невозможно предсказать формульный состав металлидов (соединений металлов друг с другом) на основе представлений о валентности.
Металлическая связь не исключает некоторой доли ковалентнюсти. В чистом виде металлическая связь наблюдается у щелочных и щелочноземельных металлов. О некоторой доли ковалентности связи у d-металлов свидетельствует ряд их физических свойств: температура плавания и кипения, энергия атомизации, твердость, межатомные расстояния. Установлено, что лишь небольшая часть валентных электронов у них находится в состоянии обобществления, примерно один электрон на атом. Остальные же электроны осуществляют направленные ковалентные связи между соседними атомами. Эти ковалентные связи образуются в первую очередь за счет перекрывания внутренних d-орбиталей, т.к. d-орбитали имеют более сложную конфигурацию и больший размер. Это особенно заметно для элементов середины вставных декад (W и др.), характеризующихся максимальным числом неспаренных электронов.
Все свойства металлов определяются природой металлической связи. Но наиболее специфическим их свойством является отрицательный температурный коэффициент электрической проводимости, т.е. с ростом температуры электропроводность металлов уменьшается. Носителями тока в металлах являются обобществленные электроны − электроны проводимости.
Друде и Лоренц к этим электронам применили кинетическую теорию газов и смогли хорошо объяснить закон Ома и связь электропроводности с теплопроводностью (закон Видемана-Франца). Действительно, согласно теории свободных (обобществленных) электронов Друде и Лоренца, кинетическая энергия электрона равна
![]()
где k − постоянная Больцмана.
Из этого уравнения следует, что с ростом температуры должна расти кинетическая энергия электронов, а следовательно и электропроводность. Однако наблюдается все наоборот: при росте температуры электропроводность падает, т.е. температурный коэффициент электропроводности отрицателен.
Поведение электронов проводимости правильно описывает квантовая теория металлов (приложение квантовой статистики к металлам):
электроны системы неразличимы;
обязательное выполнение принципа Паули;
изменение состояния электронов определяется изменением хотя бы одного из квантовых чисел.
Эта теория приводит к следующему:
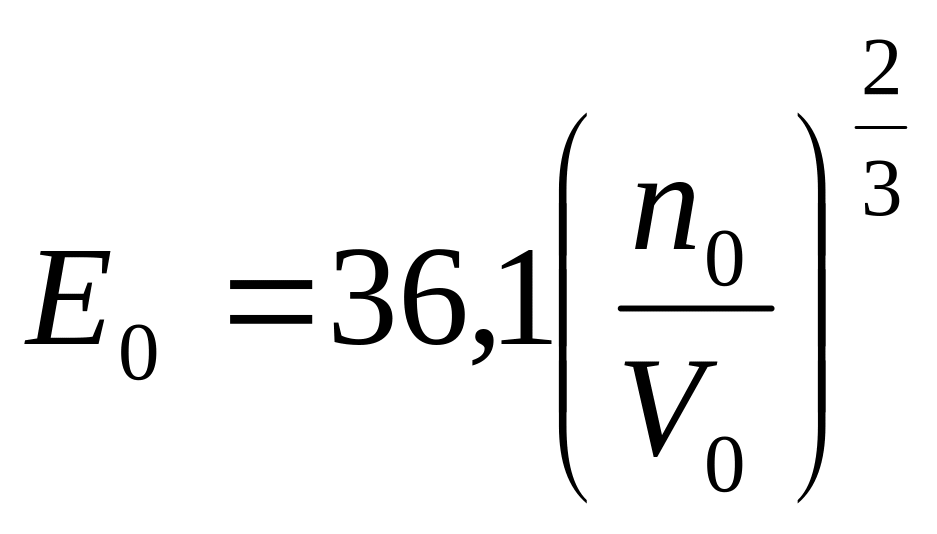 ,
,
Таким образом, согласно квантовой теории, электроны в Me уже при 0 К имеют энергию на два порядка выше энергии, рассчитанной по кинетической теории газов при комнатной температуре. Отсюда повышение температуры практически не влияет на скорость электронов: говорят, что электроны проводимости энергетически вырождены. В результате вырождения с повышением температуры металлы уменьшают свою электропроводность.
Объяснение: с ростом температуры увеличивается амплитуда колебаний атомов в узлах кристаллической решетки, это ведет к более интенсивному рассеянию электронов (длина свободного пробега электронов падает, что уменьшает их подвижность). Колебания атомных остовов решетки уподобляются стоячим звуковым волнам. Кванты звуковых волн называются фононами. С ростом температуры энергия фононов растет, а вместе с ней растет рассеяние электронов на фононах.
Уменьшение электропроводности металлов с ростом температуры обусловлено уменьшением подвижности электронов проводимости.
