
Межмолекулярное взаимодействие
Оно наблюдается между уже готовыми частицами (ионами, молекулами), находящимися на расстоянии значительно большем их собственных размеров. Сюда относят:
ион-дипольное взаимодействие;
диполь-дипольное взаимодействие;
взаимодействие «постоянный диполь - наведенный диполь»;
взаимодействие «мгновенный диполь - наведенный диполь»;
водородную связь;
межмолекулярное отталкивание.
Чтобы вещество могло перейти из газообразного состояния в жидкое и твердое, между его молекулами должны действовать силы притяжения. В 1873 году они впервые были открыты Ван-дер-Ваальсом и названы его именем. По своей природе они являются неионными и нековалентными и имеют различное происхождение.
В зависимости от природы взаимодействующих частиц (молекул) различают три составляющие Ван-дер-Ваальсовых сил:
ориентированные силы − наблюдаются при ион-дипольном и диполь- дипольном взаимодействии, т.е. ориентационном взаимодействии;
индукционные силы − наблюдаются при взаимодействии «диполь - наведенный диполь», т.е. индукционном взаимодействии;
дисперсионные силы − наблюдаются при взаимодействии «мгновенный диполь - наведенный диполь», т.е. дисперсионном взаимодействии.
Рассмотрим все виды молекулярного взаимодействия.
I. Ион-дипольное взаимодействие.
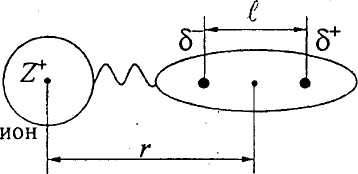
Наблюдается между ионом с зарядом Z+ или Z− и полярной молекулой, т.е. диполем. Последняя обладает дипольным моментом, равным
![]() =
δ∙l,
=
δ∙l,
где δ − заряд, l - длина диполя.
В электрическом поле иона диполь ориентируется параллельно градиенту поля (см. рис.).
Полярная молекула
r
− расстояние между геометрическими
центрами иона и диполя; Z+
−
заряд катиона; Z−
−
заряд аниона
![]() ,
,
где ε0 − диэлектрическая постоянная вакуума.
Это
взаимодействие подобно притяжению
ионов. Оно наблюдается при
растворении и диссоциации ионных
кристаллов в полярных растворителях.
При этом в растворе образуются сольваты
- ионы, окруженные молекулами растворителя.
Если растворитель - вода, то
сольваты
называются гидратами, например Na(H2O)![]() ,
F(H2O)
,
F(H2O)![]() .
.
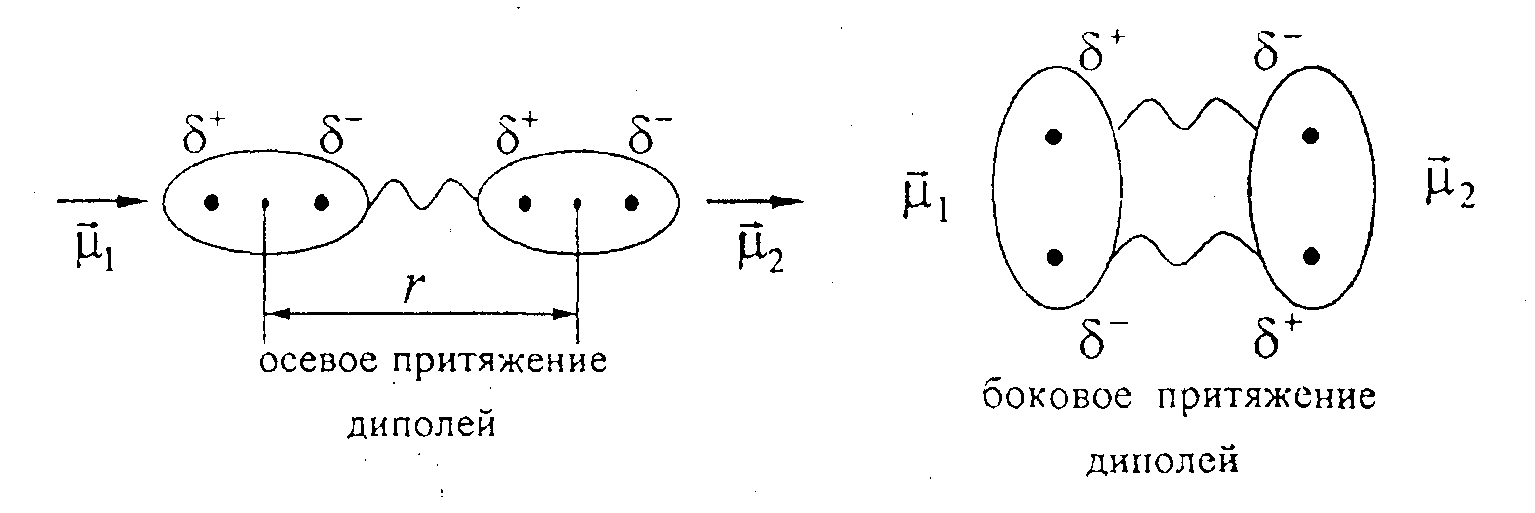
II. Диполь-дипольное взаимодействие.
Наблюдается между двумя полярными молекулами (диполями), каждая из которых обладает дипольным моментом 1, и 2. Оно проявляется во взаимной ориентации диполей друг относительно друга (см. рис.).
Оно
слабее ион-диполъного взаимодействия
и в большей степени зависит
от расстояния между взаимодействующими
диполями
![]() .
Оно проявляется в таких полярных
жидкостях, как вода и фтороводород.
Энергия диполь-дипольного взаимодействия,
называемая Энергией
Кеезома,
равна (для осевого расположения диполей):
.
Оно проявляется в таких полярных
жидкостях, как вода и фтороводород.
Энергия диполь-дипольного взаимодействия,
называемая Энергией
Кеезома,
равна (для осевого расположения диполей):
![]() .
.
Ек еще называют энергией ориентационного взаимодействия.
Энергия такого взаимодействия уменьшается с ростом температуры. Для двух однородных взаимодействующих полярных молекул
![]() ,
,
где k − постоянная Больцмана, l − расстояние между диполями.
III. Взаимодействие «постоянный диполь - наведенный диполь»
При приближении к неполярной молекуле иона, ее электронное облако искажается точно так же, как под действием катиона искажается электронное облако аниона. Это явление называется поляризацией нейтральной частицы (наведение в ней диполя) под действием внешнего поля. Оно происходит благодаря наличию у молекулы свойства поляризуемости γ. Энергия между ионом и наведенным диполем равна
![]() .
.
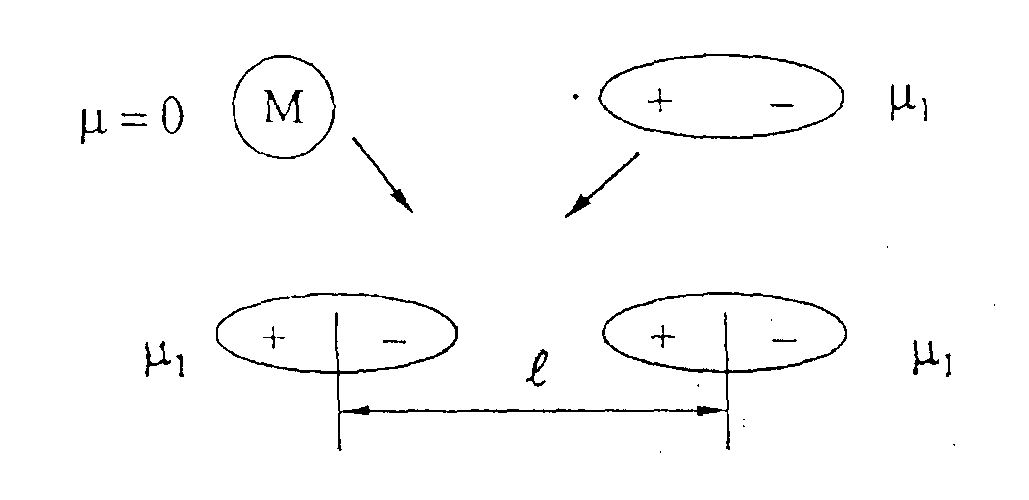
Аналогично постоянный диполь индуцирует распределение зарядов в неполярной молекуле. Затем постоянный и наведенный диполи взаимодействуют (см. рис.).
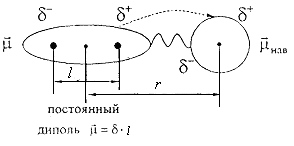
Штриховая линия означает наведение диполя в неполярной молекуле нав.
Энергия притяжения между ними, называемая энергией Дебая, равна
![]()
где нав − момент наведенного диполя, γ − электронная поляризуемость (деформируемость) неполярной молекулы. P = ε0∙γ − электронная поляризация.
Это взаимодействие слабое. Оно проявляется в растворах полярных соединений в неполярных растворителях и не зависит от температуры.
![]()
где 1, 2 − соответственно постоянный и наведенный диполь, l − расстояние между центрами диполей.
