
- •Тема: «Химия металлов» Технологическая карта комплекса
- •План лекции
- •Особенности электронного строения металлов.
- •Положение металлов в псхэ.
- •Закономерности в изменении свойств элементов – металлов.
- •Металлическая химическая связь. Кристаллические решетки.
- •Физические свойства металлов
- •Х имические свойства металлов.
- •Способы получения металлов
- •Закрепление знаний Контрольные вопросы
- •Задания и задачи
- •1. Написать уравнения реакций взаимодействия между веществами:
- •2. Расставить коэффициенты, найти окислитель и восстановитель в уравнениях реакций:
- •Химический диктант
- •Тест по теме «Общая характеристика металлов. Электрохимический ряд напряжений»
- •Ключ к тесту
- •Это интересно!
- •1.В начале был век медный.
- •II. Далее идёт век бронзовый.
- •III. Далее идет железный век.
- •Карточки задания для индивидуальной работы
- •Химические свойства
- •Характеристика элементов главной подгруппы II группы.
- •Химические свойства
- •Взаимодействие с простыми веществами.
- •Взаимодействуют с водой.
- •Взаимодействие с кислотами.
- •Взаимодействие с щелочами.
- •Характеристика элементов главной подгруппы III группы. Алюминий.
- •Строение атомов металлов изученных групп
- •Общие химические свойства
- •Закрепление и проверка знаний Контрольные вопросы
- •Упражнения и задачи для закрепления и проверки знаний
- •Железо.
- •Марганец
- •Химические свойства
- •Взаимодействие с неметаллами
- •Взаимодействие с водой
- •Взаимодействие с кислотами
- •Восстановление металлов из оксидов
- •Понятие о сплавах.
- •Задания для закрепления и проверки знаний Контрольные вопросы:
- •Характеристика элемента-металла на примере
- •Тест по теме «Металлы» Вариант 1
- •Вариант 2
- •Тест по теме «Металлы» Вариант 3
- •Вариант 4
- •Тест Вариант 1
- •Вариант 2
- •I уровень
- •II уровень
- •Контрольные вопросы, задания и тест для отработки нб по теме: «Химия металлов»
- •Тест «Химия металлов» Часть а (задания с выбором ответа)
- •Часть в (задания с кратким ответом)
- •Игровые задания Загадки о металлах
- •«Химические перевертыши»
- •Викторина по теме «Металлы»
- •Ответы на вопросы викторины
- •Определите металл
План лекции
Положение металлов в периодической системе.
Особенности электронного строения их атомов.
Металлическая химическая связь. Металлическая кристаллическая решётка.
Физические свойства металлов
Химические свойства металлов.
Способы получения металлов.
Особенности электронного строения металлов.
Металлы - это химические элементы, атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя, превращаясь в положительные ионы. Металлы – восстановители Ме0 – nе = Меn+. Это обусловлено небольшим числом электронов внешнего слоя (в основном 1 - 3), большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
Положение металлов в псхэ.
Легко увидеть, что большинство элементов ПСХЭ – металлы (92 из 114).
Металлы
размещены в левом нижнем углу ПСХЭ. Это
все элементы, расположенные ниже
диагонали В – Аt,
даже те у которых на внешнем слое 4
электрона ( Je,
Sn,
Pb),
5 электронов ( Sb,
Di),
6 электронов ( Po),
так как они отличаются большим радиусом.
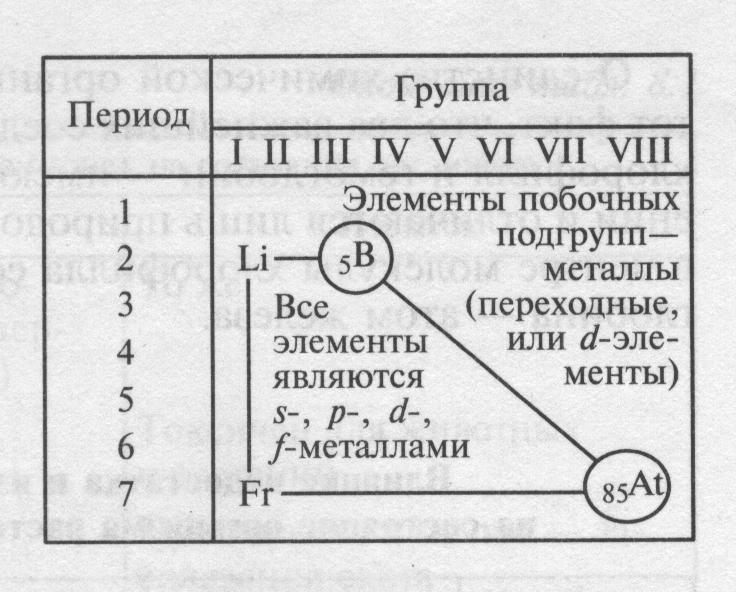 Среди
них есть s
и p-элементы
– металлы главных подгрупп, а также d
и f
металлы, образующие побочные подгруппы.
Среди
них есть s
и p-элементы
– металлы главных подгрупп, а также d
и f
металлы, образующие побочные подгруппы.
В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп). Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп происходит достраивание d- и f-подуровней.
Закономерности в изменении свойств элементов – металлов.
Признаки сравнения
|
В главной подгруппе |
В периоде |
Число электронов на внешнем слое |
не изменяется |
увеличивается |
Радиус атома |
увеличивается |
уменьшается |
Электроотрицательность |
уменьшается |
увеличивается |
Восстановительные свойства |
усиливаются |
уменьшаются |
Металлические свойства |
усиливаются |
уменьшаются |
У элементов – металлов побочных подгрупп свойства чуть-чуть другие.
В побочных подгруппах (Cu, Ag, Au) – активность элементов – металлов падает. Эта закономерность наблюдается и у элементов второй побочной подгруппы Zn, Cd, Hg. У элементов побочных подгрупп – это элементы 4-7 периодов – с увеличением порядкового элемента радиус атомов изменятся мало, а величина заряда ядра увеличивается значительно, поэтому прочность связи валентных электронов с ядром усиливается, восстановительные свойства ослабевают.
Металлическая химическая связь. Кристаллические решетки.
Связь в металлах между («атом-ионами» ) посредством (большого количества не связанных с ядрами подвижных электронов) называется (металлической связью).
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
|
|
|
|
кубическая (1 атом на ячейку)
а) |
объемно-центрированная кубическая (ОЦК) (2 атома на ячейку) б) |
гранецентрированная кубическая (ГЦК) (4 атома на ячейку) в) |
гексагональная плотноупакованная (ГП) (6 атомов на ячейку) г) |
Рис. Основные типы кристаллических решеток металлов
Обобщим сведения о типе химической связи, образуемой атомами металлов и строение кристаллической решетки:
- сравнительно небольшое количество электронов одновременно связывают множество ядер, связь делаколизована;
- валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален;
- металлическая связь не обладает направляемостью и насыщенностью.




