- •Введение
- •Лабораторная работа № 6 Изучение типов свертывания белков
- •Лабораторная работа № 7 Влияние тепловой обработки на белки протоплазмы Цель работы: изучить влияние тепловой обработки на состояние белков протоплазмы растительных клеток
- •Задание 1: продемонстрировать диффузию растворимых веществ клеточного сока вследствие изменения белков протоплазмы при тепловой обработке овощей. Техника выполнения работы.
- •Методика работы на рефрактометре.
- •Лабораторная работа № 9
- •Лабораторная работа № 10
- •Лабораторная работа № 11
- •В формировании цвета нагретого масла участвуют темноокрашенные вторичные продукты окисления (например, продукты, конденсации дикарбонильных соединений).
Лабораторная работа № 11
Изменение свойств растительного масла в процессе фритюрной жарки
Цель работы - установление степени изменения цвета растительного масла в зависимости от его вида (рафинированное, нерафинированное);
зависимости между изменением цвета и появлением специфического привкуса и запаха нагретого масла;
степени изменения физических показателей растительного масла в зависимости от продолжительности и температуры его нагрева;
сравнение степени окисленности подсолнечного масла свежего и прогретого в течение 4, 8 и 12 ч при температуре 180 °С.
Продолжительное использование растительного масла в качестве фритюра сопровождается изменением его органолептических показателей (потемнением, появлением специфического запаха и вкуса, изменением консистенции - загустением), физических свойств (возрастанием коэффициента преломления, удельной массы и вязкости), а также окислением и гидролизом триацилглицеринов. Гидролиз в свою очередь способствует окислительным превращениям, поскольку образующиеся в ходе его свободные жирные кислоты окисляются легче связанных.
В формировании цвета нагретого масла участвуют темноокрашенные вторичные продукты окисления (например, продукты, конденсации дикарбонильных соединений).
Определенная зависимость между изменением цвета и вкуса масла свидетельствует о том, что окраска в какой-то мере обусловлена меланоидинами, а в случае использования нерафинированных масел, кроме того, - меланофосфатидами - продуктами реакции редуцирующих сахаров с аминоспиртами фосфатидов.
Возрастание коэффициента преломления свидетельствует о появлении в масле в результате окисления новых функциональных групп (карбонильных, карбоксильных, оксигрупп) и формировании новых пространственных и других изомеров. Увеличение удельной массы и вязкости является следствием накопления в масле полимеров, в образовании которых принимают участие ненасыщенные жирные кислоты, соединения с сопряженными двойными связями, дикарбонильные соединения и другие продукты термического разложения глицеридов.
Начальный этап термического окисления характеризуется накоплением перекисных соединений, в основном гидроперекисного типа. Эти соединения являются высокоактивными и вскоре распадаются с образованием промежуточных (спирты, альдегиды, кетоны) и вторичных (дикарбонильные соединения, эпо-киси, производные кислот с двумя сопряженными двойными связями и др.) продуктов окисления. Стабильные продукты окисления обусловливают снижение пищевой доброкачественности и биологической ценности жира.
Приборы, оборудование и материалы: весы технохимические; рефрактометр; баня водяная; секундомер; термометр на 1000С; вискозиметр капиллярный диаметром 1 мм; пробирки с пробками; цилиндр на 100 мл; колбы вместимостью 250 мл; микробюретка; стекла предметные; растворы стандартные йода; нейтральная смесь этилового спирта и этилового эфира в соотношении 1:2; 0,1 н. раствор КОН; спиртовой раствор фенолфталеина; 1%-ный раствор тимолфталеина; жирорастворитель.
Задание 1: определить запах, вкус и цвет образцов масла.
Техника выполнения работы.
В восемь пробирок налить по 15 мл подсолнечного масла (рафинированного и нерафинированного свежего и прогретого в течение 4, 8 и 12 ч при температуре 180 °С).
Перед определением запаха пробирки с маслом закрыть пробками и нагреть на водяной бане до температуры 50 °С. Образец подогретого масла нанести тонким слоем на предметное стекло. Расположить пробы в ряд по возрастанию интенсивности запаха, отмечая оттенки его (отсутствие постороннего запаха, отсутствие запаха, присущего подсолнечному маслу, слабо выраженный, выраженный или резко выраженный неприятный запах термического распада масла и др.).
Оценку вкуса надо начинать с пробы, обладающей минимальной интенсивностью запаха. Взять в рот около 3-5 мл масла, распределить его по всей полости рта и подержать примерно 25-30 с. Отметить наличие или отсутствие постороннего привкуса, наличие или отсутствие горьковатого привкуса разной интенсивности, вкуса, вызывающего неприятное ощущение першения. Затем пробу удалить изо рта, тщательно прополоскав рот теплой водой.
Цвет исследуемых образцов масла сравнить с окраской эталонов, в качестве которых использовать шкалу стандартных растворов йода. Для характеристики цвета с использованием шкалы определяют цветное число масел, которое выражается количеством миллиграммов свободного йода, содержащегося в 100 см3 стандартного раствора йода, имеющего при одинаковой с маслом толщине слоя 1 см такую же интенсивность окраски, как испытуемое масло (приготовление шкалы стандартных растворов йода выполняют лаборанты кафедры). Для определения цветного числа масел сравнение интенсивности окраски масла с окраской стандартных растворов йода ведут в проходящем и отраженном дневном свете или при матовой электрической лампочке. Цветное число испытуемого масла принимают равным цветному числу эталона, имеющего одинаковую окраску с маслом.
Результаты оформить в таблицу 13.
Задание 2: определить вязкость и коэффициент преломления свежего масла (рафинированного или нерафинированного) и масла, прогретого в течение 4, 8 или 12 ч.
Техника выполнения работы.
Вязкость масла определить с помощью капиллярного вискозиметра. После исследования каждого образца масло из вискозиметра вылить, промыть прибор жирорастворителем (с жирорастворителем работать под тягой) и просушить в сушильном шкафу.
Изменение вязкости масла в процессе нагревания выразить отношением времени истечения нагретого масла ко времени истечения исходного.
Коэффициент преломления образцов масла определить в рефрактометре с точностью до 0,0002. После совмещения границы раздела света и тени с перекрестием сетки отсчитать по шкале целые, десятые, сотые и тысячные доли значения показателя преломления, десятитысячные доли оценить на глаз.
Замер провести 2-3 раза и подсчитать среднее арифметическое значение.
Результаты исследований свести в таблицу 13.
Таблица 13 - Изменения органолептический и физических показателей растительного масла в зависимости от продолжительности его нагрева
Образцы масел |
Органолептические показатели |
Физические показатели |
|||
запах, вкус |
цвет |
цветное число |
вязкость |
коэффициент преломления |
|
|
|
|
|
|
|
Сделать вывод о зависимости:
изменения цвета масла при продолжительном нагревании от вида его;
между цветом масла и другими органолептическими показателями (его вкусом и запахом);
физических свойств масла от продолжительности нагревания.
Задание 3: определить кислотное число в свежем масле (рафинированном или нерафинированном) и масле, прогретом в течение 4, 8 или 12 ч.
Техника выполнения работы.
Кислотное число характеризует накопление свободных жирных кислот при термическом окислении масла.
В коническую колбу вместимостью 250 мл отвесить на технохимических весах 3-5 г жира, прилить 50 мл нейтральной смеси (1:2) 96 %-ного этилового спирта и этилового эфира, перемешать до полного растворения жира и добавить 3-4 капли 1 %-ного спиртового раствора фенолфталеина. Если масло темное, то вместо фенолфталеина следует добавить 2 мл 1 %-ного раствора тимолфталеина. Раствор масла быстро оттитровать из микробюретки 0,1 н. водным раствором гидрата окиси калия до появления слабо-розовой окраски, устойчивой в течение 30 с, если в качестве индикатора использовался фенолфталеин, или синей - при использовании тимолфталеина. Кислотное число вычисляют по формуле
![]() (13)
(13)
где b - количество 0,1 н. раствора КОН, израсходованного на титрование, мл;
k - поправка к титру раствора КОН;
5,611 - титр точно 0,1 н. раствора КОН; а - навеска жира, г.
Результаты исследования свести в таблицу 14.
Таблица 14 – Влияние длительности нагрева масла на кислотное число
Наименование образцов |
Кислотное число |
|
|
Сделать выводы по проделанной работе.
Лабораторная работа № 12
Изучение влияния различных факторов на степень инверсии сахарозы
Цель работы - продемонстрировать влияние различных факторов: продолжительности нагревания; концентрации кислоты; степени диссоциации кислоты на степень инверсии сахарозы.
В состав пищевых продуктов входят различные углеводы - от низкомолекулярных моносахаридов до высокополимерных полисахаридов. Изменения углеводов, имеющие место при технологической обработке пищевых продуктов, весьма разнообразны.
Сахароза, содержащаяся в пищевых продуктах и добавляемая по рецептуре при изготовлении различных изделий, при нагревании может гидролизоваться (подвергаться инверсии) с образованием инвертного сахара – смеси глюкозы и фруктозы. Гидролиз сахарозы протекает при нагревании ее концентрированных растворов, например, при варке помады, он существенно усиливается в присутствии кислот. Гидролитическое расщепление сахарозы наблюдается при изготовлении плодово-ягодных киселей, компотов, желе, муссов, запекании яблок, тушении свеклы и др. процессах. Количество образующегося инвертного сахара обусловлено в значительной мере количеством присутствующей кислоты, степенью ее диссоциации, а также режимом тепловой обработки.
Гидролиз сахарозы можно изучать на модельных опытах с ее чистыми растворами, в которые добавлены органические кислоты.
Приборы, оборудование и материалы: весы;технохимические плитка электрическая; бюретка для горячего титрования; два стакана химических на 100 мл; две колбы мерные на 250 мл; цилиндр мерный на 50 мл; пипетка на 10 мл; две воронки; две колбы конические на 100 мл; часы песочные на 1 и 5 мин.; шпатель; 1%-ный раствор железосинеродистого калия; 2,5 н. раствор гидрата окиси натрия; 1%-ный водный раствор метиленового голубого; 6%-ный раствор лимонной кислоты; 6 %-ный раствор уксусной кислоты или 6 %-ный раствор яблочной кислоты.
Задание 1: изучить влияние продолжительности тепловой обработки на гидролиз сахарозы.
Техника выполнения работы.
Для изучения влияния продолжительности тепловой обработки на гидролиз сахарозы приготовить по указанию преподавателя два одинаковых сиропа по какой-либо из приведенных в таблице 15 рецептур.
Таблица 15 – Соотношение компонентов в растворе
№ раствора |
Количество |
||
сахарозы, г |
раствора лимонной кислоты, мл |
дистиллированной воды, мл |
|
|
|
3 |
2 |
40 |
|
|
3 |
5 |
37 |
|
|
4 |
2 |
40 |
|
|
4 |
5 |
37 |
При изготовлении сиропа отвесить на технохимических весах две навески сахарозы, перенести их в химические стаканы вместимостью 100 мл, добавить необходимое количество воды, раствор лимонной кислоты и быстро довести смесь до кипения. При изучении влияния продолжительности нагревания эти одинаковые сиропы кипятят разное время: от 1 до 5 мин (по указанию преподавателя).
После кипячения сиропы быстро охладить до комнатной температуры под струей холодной воды и количественно перенести в мерную колбу вместимостью 250 мл. Остатки сиропа смыть дистиллированной водой в ту же мерную колбу. Содержимое колбы довести до метки дистиллированной водой, раствор перемешать и использовать для определения инвертного сахара цианидным методом.
Цианидный метод определения сахаров основан на восстановлении испытуемым раствором редуцирующих сахаров определенного количества железосинеродистого калия (красной кровяной соли) в железисто-синеродистый калий (желтую кровяную соль). По количеству раствора инвертного сахара, израсходованного на восстановление красной кровяной соли, рассчитывают содержание сахара в нем. Титрование железосинеродистого калия раствором редуцирующих сахаров проводится в щелочной среде при нагревании в присутствии метиленового голубого в качестве индикатора, который в конце реакции восстанавливается сахарами в бесцветное лейкооснование. В связи с этим синий цвет раствора исчезает, как только появляется избыточная капля раствора редуцирующего сахара, что указывает на конец реакции. При этом раствор окрашивается в желтый цвет благодаря присутствию желтой кровяной соли. Взаимодействие редуцирующих сахаров не является стехиометрической реакцией, поэтому сахара определяют в два этапа. Сначала проводят ориентировочное титрование, а затем контрольное.
При определении сахара цианидным методом необходимо строго соблюдать условия опыта, так как результаты зависят от продолжительности кипячения раствора, интенсивности кипения, скорости приливания раствора при дотитровывании.
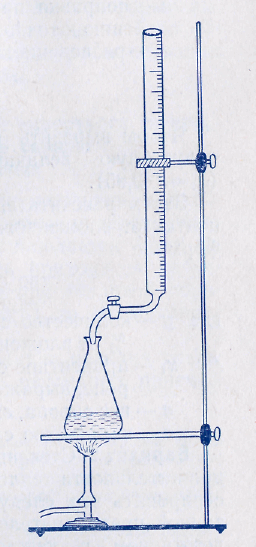
Ориентировочное титрование. В специальную бюретку для горячего титрования (рис.1) налить раствор инвертного сахара. В коническую колбу вместимостью 100 мл из пипетки налить точно 10 мл 1 %-ного раствора железосинеродистого калия, добавить 2,5 мл 2,5 н. раствора гидрата окиси натрия и одну каплю метиленового голубого. Смесь быстро нагреть на электроплитке с сеткой до кипения и осторожно титровать ее (1 капля в 1 с) при постоянном кипении раствором инвертного сахара до перехода зеленой окраски (через фиолетовую) в светло-желтую. Перемешивание жидкости происходит при кипении.
При охлаждении оттитрованный раствор приобретает фиолетовую окраску вследствие окисления бесцветного лейкооснования кислородом воздуха, на изменение окраски не следует обращать внимания. Контрольное титрование. В коническую колбу вместимостью 100 мл налить из пипетки 10 мл 1 %-ного раствора железосинеродистого калия, 2,5 мл 2,5 н. раствора гидрата окиси натрия и испытуемый раствор в количестве на 1 мл меньше, чем было израсходовано при ориентировочном титровании. Смесь нагреть до кипения, прокипятить 1 мин, прибавить каплю метиленового голубого и дотитровать смесь до появления желтой окраски. Продолжительность кипения раствора не должна превышать 3 мин. Наиболее точные результаты получаются в тех случаях, когда на титрование расходуется 5 - 6 мл раствора инвертного сахара. Расчеты следует производить по результатам контрольного титрования, просуммировав объемы растворов редуцирующих сахаров, прилитые до кипячения и при дотитровывании. |
|
Рис. 1. Бюретка для горячего титрования |
Содержание сахарозы (X, %), превратившейся в инвертный сахар, рассчитать по формулам:
X=![]() (14)
(14)
где К - поправочный коэффициент на 1 %-ный раствор железосинеродистого калия;
10,06 и 0,0175 - эмпирические коэффициенты;
V - объем раствора инвертного сахара, пошедший на восстановление 10 мл 1 %-ного раствора железосинеродистого калия при контрольном титровании, мл;
V1 - объем колбы, в которую перенесен сироп, мл;
m - масса сахарозы, г;
10 - коэффициент пересчета;
0,95 - коэффициент пересчета инвертного сахара на сахарозу.
Результаты эксперимента оформить в таблицу 2.
Задание 2: определить влияние концентрации кислоты на гидролиз сахарозы.
Техника выполнения работы.
Для изучения влияния концентрации кислоты на гидролиз сахарозы приготовить по указанию преподавателя 2 вида сиропов с одинаковым количеством сахарозы и разным количеством лимонной кислоты. Общий объем кислоты и воды должен быть одинаковым в обоих сиропах (таблица 16). Сиропы прокипятить в течение 3-х минут. После кипячения сиропы быстро охладить до комнатной температуры под струей холодной воды и количественно перенести в мерную колбу вместимостью 250 мл. Остатки сиропа смыть дистиллированной водой в ту же мерную колбу. Содержимое колбы довести до метки дистиллированной водой, раствор перемешать и использовать для определения инвертного сахара цианидным методом.
Результаты эксперимента оформить в таблицу 2.
Задание 3: определить влияние степени диссоциации кислоты на гидролиз сахарозы.
Техника выполнения работы.
Для изучения влияния степени диссоциации кислоты на гидролиз сахарозы приготовить по указанию преподавателя 2 вида сиропов, приготовленных по одной их тех рецептур, которые изучались в задании 2, добавив в один сироп вместо лимонной кислоты 6 %-ный раствор уксусной кислоты, а в другой сироп - 6 %-ный раствор яблочной кислоты. Сиропы прокипятить в течение 3-х минут. После кипячения сиропы быстро охладить до комнатной температуры под струей холодной воды и количественно перенести в мерную колбу вместимостью 250 мл. Остатки сиропа смыть дистиллированной водой в ту же мерную колбу. Содержимое колбы довести до метки дистиллированной водой, раствор перемешать и использовать для определения инвертного сахара цианидным методом.
Результаты эксперимента оформить в таблицу 16.
Таблица 16 – Влияние различных факторов на гидролиз сахарозы
№ раствора |
Продолжительность кипячения, мин |
Кислота, добавленная в сироп |
Количество кислоты |
Количество инвертного сахара |
|
|
|
|
|
|
|
|
|
|
Сделать выводы по работе.
Лабораторная работа № 13
Изучение влияния температуры нагревания на карамелизацию
сахарозы
Цель работы - проследить за изменением органолептических свойств сахарозы (цвета, вкуса, запаха) при нагревании ее до различных температур; определить максимальную температуру, при которой происходит образование наиболее интенсивно окрашенных веществ, не обладающих резкой горечью.
При нагревании сахаров выше температуры их плавления начинается процесс карамелизации. При этом образуется много различных соединений - ангидриды сахаров, продукты реверсии, кетоны, фурфурол, оксиметилфурфурол и другие альдегиды; при еще более высоких температурах появляются летучие вещества (окись и двуокись углерода и др.). Накопление продуктов реакций уплотнения (конденсации и полимеризации) приводит к образованию окрашенных соединений.
В результате ряда сложных процессов изменяются цвет и вкус исходного сахара, появляется своеобразный запах, меняющийся в зависимости от температуры нагревания. Чем выше температура, до которой нагревают сахар, тем большим изменениям он подвергается. Интенсивность окраски пропорциональна накоплению веществ, придающих продуктам карамелизации горький вкус.
При смачивании сахара водой и его интенсивном нагревании происходит образование водорастворимых окрашенных веществ темно-коричневого цвета, которые называются «жженый» сахар или «жженка».
Приборы, оборудование и материалы: тигель фарфоровый; термометр на 250 - 300°; цилиндр мерный емкостью 50 мл; четыре колбы мерные емкостью 50 мл; воронка маленькая; пипетка емкостью 2 мл; часовое стекло.
Задание: изучить влияние температуры нагревания на интенсивность карамелизации сахаров.
Техника выполнения работы.
На технохимических весах отвесить 10 г сахара, перенести навеску в тигель и смочить ее 2 мл воды. Затем в мерном цилиндре приготовить 20 мл дистиллированной воды. Тигель поставить на электроплитку и нагревать. Температуру сахарного расплава замерять термометром, не касаясь дна и стенок тигля. Нагревание вести до максимальной температуры 160 °С.
После этого жженый сахар осторожно залить небольшим количеством дистиллированной воды из цилиндра и, помешивая, растворить всю массу. Полученную жженку перелить в мерную колбу. Водой из цилиндра в несколько приемов ополоснуть тигель и все промывные воды слить в колбу. Охладив ее содержимое до комнатной температуры, долить водой до метки и тщательно перемешать.
Опыт повторить еще три раза, нагревая сахар до температур 180, 200 и 220 °С. Затем произвести органолептическую оценку всех растворов жженого сахара и отметить, какой из них наиболее интенсивно окрашен, но не имеет еще резких горечи и запаха.
Данные свести в таблицу 17.
Таблица 17 – Влияние температуры нагрева сахарозы на органолептические показатели жженого сахара
Максимальная температура нагревания сахара, °С |
Цвет |
Вкус |
Запах |
160 |
|
|
|
180 |
|
|
|
200 |
|
|
|
220 |
|
|
|
Сделать вывод по работе.
Эту работу можно варьировать, нагревая сахар до различных температур, например: 1) 170, 200, 230 °С;
2) 200, 210, 220, 230 °С;
3) 215, 220, 225 °С.
Лабораторная работа № 14
Изучение клейстеризации картофельного крахмала
Цель работы - показать изменение внешнего вида крахмальных зерен, органолептических свойств крахмала в процессе влажного нагрева, а также выявить влияние на скорость клейстеризации отдельных технологических факторов.
Тепловая обработка крахмалосодержащих продуктов в процессе влажного нагрева сопровождается изменением крахмала - клейстеризацией.
Клейстеризация, или разрушение нативной структуры крахмальных зерен при нагревании с водой, протекает в несколько стадий. При нагревании водной суспензии крахмальных зерен до 55 0С происходит медленное поглощение ими воды (до 50%) и частичное набухание, при этом повышении вязкости суспензии не наблюдается, зерна крахмала становятся прозрачными, несколько увеличиваются в объеме, не теряя при этом слоистости.
При дальнейшем нагревании суспензии (в интервале температуры от 60 до 100 0С) набухание крахмальных зерен ускоряется, они увеличиваются в объеме. Этот процесс набухания необратим, часть крахмальных полисахаридов растворяется и они переходят в окружающую среду. Крахмальное зерно увеличивается в размерах в несколько раз, разрушается его кристаллическая структура и теряется слоистость. Этот процесс называется клейстеризацией крахмала и происходит в интервале температур 55-80 0С, при этом резко увеличивается вязкость суспензии.
При длительном нагревании крахмального клейстера при температуре более 80 0С происходит распад крахмальных зерен и полисахаридов, снижается вязкость клейстера. Продолжительное нагревание крахмальных клейстеров при высокой температуре (90 0С и выше) может вызвать разрушение зерен.
Сильно набухающие зерна картофельного крахмала менее устойчивы к нагреванию в воде и быстрее разрушаются, чем зерновых крахмалов.
При изготовлении кулинарных изделий, в состав которых входит крахмал (супов-пюре, соусов, киселей и др.), последний клейстеризуется в присутствии поваренной соли, сахаров, жира, органических кислот и других составных частей пищевых продуктов. Все перечисленные вещества оказывают влияние на вязкость клейстера, которая, в свою очередь, обусловливается степенью набухания крахмальных зерен (видимая вязкость), природой и свойствами растворенных крахмальных полисахаридов и степенью их ориентации.
Приборы, оборудование и материалы: микроскоп; стекла предметные, покровные и часовые; палочки стеклянные; стаканы химические; бани водяные и песчаная; вискозиметр капиллярный; термостат; секундомер; часы песочные; четыре колбы конические емкостью 100 мл с воздушными обратными холодильниками; 0,004 н. раствор йода в йодистом калии; 1%-ный раствор поваренной соли; 20%-ный раствор сахарозы; 0,4%-ный раствор лимонной кислоты.
Задание 1: изучить изменение вида зерен картофельного крахмала в водной суспензии при различных температурах.
Техника выполнения работы.
При микроскопическом изучении процесса клейстеризации о степени набухания крахмальных зерен судят, прежде всего, по изменению их размера. Поэтому для работ, связанных с микроскопированием, нужен крахмал с одинаковыми размерами зерен. Фракционирование крахмальных зерен по размерам основано на различной скорости седиментации их из водной суспензии.
Сто граммов продажного крахмала заливают 500 мл воды и, интенсивно перемешивая, получают однородную суспензию. Дают ей отстояться в течение 12-15 мин. и сливают в стакан жидкость над осадком, содержащую преимущественно мелкие зерна. Операцию суспензирования, отстаивания и декантации повторяют 7-10 раз, сливая всякий раз жидкость над осадком в новый стакан. Время каждой последующей седиментации уменьшают на 1-2 мин. Крахмальным зернам в стаканах дают возможность осесть и сливают с осадка воду.
Подобным образом в эти же стаканы фракционируют вторую порцию крахмала (100 г), а затем третью, четвертую и пятую. Полученные в стаканах осадки крахмала сушат на воздухе или в сушильном шкафу при температуре не выше 50° и хранят в отдельных склянках. При необходимости каждую полученную фракцию крахмала можно разделить подобным образом на три-четыре подфракции (данную часть эксперимента выполняют лаборанты кафедры).
Рассмотреть под микроскопом при увеличении в 280 раз (для этого нужно пользоваться окуляром 7Х и объективом 40) и зарисовать зерна сырого картофельного крахмала.
Для приготовления препарата концом стеклянной палочки, смоченным водой, взять немного крахмала и поместить его на предметное стекло. Смочить крахмал капелькой воды и покрыть покровным стеклом. Обратить внимание на величину зерен и наличие слоистости.
В двух водяных банях нагреть воду соответственно до 70 и 90 0С. Приготовить 2%-ную водную суспензию крахмала, для чего в два химических стакана отвесить на технохимических весах по 1 г крахмала, добавить в каждый по 50 мл воды и размешать. Крахмальные суспензии нагреть при непрерывном помешивании на водяной бане до температуры: первую – 58 0С, вторую – 80 0С и, продолжая помешивать, выдержать их при этой температуре в течение 5 мин.
Приготовить неокрашенные и окрашенные йодом препараты крахмала, оклейстеризованного при 58 и 80 0С. Для этого на предметное стекло нанести каплю клейстера и покрыть его покровным стеклом, рядом (на том же предметном стекле) поместить каплю того же клейстера, окрасив его раствором йода, и покрыть покровным стеклом. Выступившую из-под покровных стекол жидкость удалить фильтровальной бумагой.
Рассмотреть препараты в микроскоп и зарисовать, отметив изменения вида крахмальных зерен в результате клейстеризации при различных температурах (появление прозрачности, изменение формы и величины зерен, наличие или отсутствие слоистости).
Задание 2: изучить разрушение крахмальных зерен при кипячении крахмального клейстера.
Техника выполнения работы.
Один из приготовленных образцов клейстера довести до кипения на песчаной бане и прокипятить в течение 1 мин. Каплю клейстера поместить на предметное стекло, окрасить препарат йодом, рассмотреть под микроскопом и зарисовать крахмальные зерна. Отметить появление разрушенных зерен.
Результаты наблюдений свести в таблицу 18.
Таблица 18 – Изменение вида крахмальных зерен в разных условиях клейстеризации
Объект наблюдения |
Характеристика крахмальных зерен |
Зерна картофельного крахмала |
|
сырого |
|
оклейстеризованного при 58 0С |
|
оклейстеризованного при 80 0С |
|
в клейстере, подвергшимся кипячению |
|
Задание 3: показать влияние постоянных ингредиентов большинства пищевых продуктов (сахара, поваренной соли, органических кислот) на вязкость клейстера картофельного крахмала.
Техника выполнения работы.
Приготовить образцы клейстеров картофельного крахмала, для чего в четыре конические колбочки емкостью 100 мл отвесить на технохимических весах по 1 г крахмала и залить навески 50 мл соответственно: дистиллированной воды; 20 %-ного раствора сахарозы; 1 %-ного раствора поваренной соли; 0,4 %-ного раствора лимонной кислоты.
Каждую колбу закрыть пробкой с воздушным холодильником, нагреть, помешивая легким встряхиванием, на песчаной бане до кипения. Прокипятить точно 1 мин. (следить по песочным часам), снять с огня и охладить под струей воды до температуры 20 °С.
Измерить вязкость клейстеров капиллярным вискозиметром.
Приготовить препараты крахмальных клейстеров для микроскопирования, окрасить их раствором йода, рассмотреть под микроскопом при увеличении 7x40 и зарисовать, обращая внимание на величину и целость крахмальных зерен.
Сделать вывод о влиянии исследуемых добавок на набухаемость зерен крахмала и связанную с ней вязкость клейстера.
Результаты наблюдений свести в таблицу 19.
Таблица 19 – Влияние добавок на набухаемость зерен крахмала и вязкость клейстера
Состав раствора для клейстеризации крахмала |
Вязкость клейстера |
Характеристика крахмальных зерен |
дистиллированная вода |
|
|
20 %-ный раствор сахарозы |
|
|
1 %-ный раствор поваренной соли |
|
|
0,4 %-ный раствор лимонной кислоты |
|
|
Сделать выводы по работе.
Лабораторная работа № 15
Изменение крахмала при сухом нагреве
Цель работы - сравнить органолептические и физико-химические свойства нативного картофельного крахмала и крахмала, подвергнутого сухому нагреву при различных температурах.
Сухой нагрев вызывает расщепление крахмала с образованием высокомолекулярных веществ - пиродекстринов и летучих продуктов - углекислого газа, окиси углерода, воды и др. Пиродекстрины растворимы в воде и окрашены в желто-коричневый цвет.
Органолептические и физико-химические свойства крахмала при сухом нагреве изменяются: белый цвет переходит сначала в слегка кремовый, а затем коричневый (различной степени интенсивности); увеличивается количество растворимых и летучих продуктов распада. Последние обусловливают появление запаха, не свойственного исходному крахмалу. По мере нагревания разрушается структура крахмальных зерен: будучи прогретыми при высоких температурах (160-180 °С), они распадаются в воде на отдельные фрагменты. Вследствие разрушения зерен, а также расщепления крахмальных полисахаридов снижается вязкость клейстера, приготовленного из декстринированного крахмала.
Степень перечисленных изменений тем значительнее, чем выше температура сухого нагрева и больше продолжительность его.
Для работы необходимо иметь крахмал картофельный, исходный и прогретый в течение 4 час. при температуре 160 и 180 °С.
Приборы, оборудование и материалы: микроскоп; рефрактометр; вискозиметр капиллярный; термостат; три колбы конические и три мерные емкостью 100 мл; четыре стакана химических емкостью 100 мл и три емкостью 25 мл; стекла предметные и покровные; три воронки; палочки стеклянные; 0,004 н. раствор йода в йодистом калии; 0,1 н. раствор едкого натра.
Задание 1: провести органолептическую оценку образцов нативного и подвергнутого сухому нагреву крахмала
Техника выполнения работы.
Цвет образцов, подвергнутых сухому нагреву, сравнивают с цветом исходного крахмала. Для этого на чистую сухую дощечку (или стекло) размером примерно 50x150 мм насыпают по 3-5 г исследуемых образцов крахмала. Гладкой лопаточкой или ребром стекла разравнивают образцы с таким расчетом, чтобы получился слой толщиной около 5 мм. Затем крахмал накрывают стеклянными пластинками и спрессовывают. Сняв стекло, сравнивают цвет прогретого крахмала с цветом нативного.
Запах крахмала определяют так: около 10-15 г крахмала обливают небольшим количеством теплой воды (температура не выше 50 °С); через 30 сек. воду сливают и устанавливают запах (запах сырого крахмала, отсутствие запаха, посторонний запах и др.).
Внешний вид оклейстеризованных зерен исследуют следующим образом. В химические стаканы отвешивают по 0,2 г каждого образца крахмала, заливают их 40 мл воды, размешивают, нагревают до кипения, кипятят и снимают с огня. Затем приготовляют препараты оклейстеризованного крахмала для микроскопирования, окрашивают их йодом, рассматривают в микроскоп, зарисовывают и отмечают различия во внешнем виде крахмальных зерен.
Задание 2: определить физико-химические показатели образцов нативного и подвергнутого сухому нагреву крахмала.
Техника выполнения работы.
Растворимость. В конические колбы емкостью 100 мл отвешивают по 1 г каждого образца крахмала, заливают 10 мл дистиллированной воды и, закрыв колбы пробками, встряхивают их в течение 15 мин. После этого содержимое колб отфильтровывают в колбу, в фильтрате определяют количество сухих веществ рефрактометром и выражают в % к весу крахмала.
Вязкость. В химические стаканчики емкостью 25 мл отвесить по 0,1 г образцов крахмала и перенести навески количественно в мерные колбы емкостью 100 мл, используя для этого 0,1 н. раствор едкого натра. Когда навеска крахмала полностью растворится (для ускорения можно поместить колбу с крахмалом на водяную баню с температурой 40-50 °С), объем жидкости в колбе довести раствором щелочи до метки и перемешать содержимое.
Относительную вязкость раствора определить в капиллярном вискозиметре.
Результаты исследований свести в таблицу 20.
Таблица 20 – Показатели нативного и подвергнутого сухому нагреву крахмала.
Наименование образцов |
Органолептические показатели |
Физико-химические показатели |
|||
внешний вид |
запах |
цвет |
растворимость |
вязкость щелочного раствора |
|
Нативный крахмал |
|
|
|
|
|
Крахмал, прогретый при 160 °С |
|
|
|
|
|
Крахмал, прогретый при 180 °С |
|
|
|
|
|
Сделать выводы по работе.
Лабораторная работа № 16
Изучение влияния технологических факторов на изменение цвета
пищевых продуктов
Цель работы - продемонстрировать влияние реакции среды на изменение цвета отдельных пищевых продуктов и изменение окраски свекольного сока при тепловой обработке в зависимости от концентрации пигментов.
Цвет сырого мяса обусловлен в основном наличием хромопротеида миоглобина. По своему строению миоглобин близок к гемоглобину, так как в состав того и другого входят простетическая группа гем и белок глобин (в гемоглобине одна молекула глобина связана с четырьмя гемами, а в миоглобине на одну молекулу глобина приходится только один гем; разница в аминокислотном составе белковых частей незначительна).
В сыром мясе в состав гема входит в основном двухвалентное железо. Характерной особенностью миоглобина является его способность легко присоединять за счет дополнительных валентностей кислород и некоторые другие соединения без изменения валентности железа.
При тепловой обработке мяса белок глобин денатурируется, а двухвалентное железо в геме окисляется до трехвалентного. Гемовый пигмент, в состав которого входит трехвалентное железо, ведет себя как индикатор: он имеет коричневую окраску в кислой среде и красную - в щелочной.
Бульон, сваренный из свежего мяса, полученного при убое здоровых животных, имеет слабокислую среду. Величина рН мясокостного бульона колеблется в пределах от 6,0 до 6,6; рН свежих костных бульонов несколько выше — 6,8 - 7,3.
Обычное вареное мясо окрашено в различные оттенки серо-коричневого цвета в зависимости от содержания миоглобина (в основном) в мышечной ткани. При сдвиге реакции среды бульона в щелочную сторону, вызванном начинающимся гнилостным распадом белков, возможно появление розоватых оттенков у вареного мяса.
Окраска многих плодов и ягод обусловлена наличием водорастворимых пигментов — антоцианов. Этой группе красящих веществ свойственны различные оттенки красного, пурпурного, фиолетового и синего цветов. Известно, что окраска антоцианов существенно зависит от реакции среды. Наиболее устойчивую красную окраску антоцианы имеют в кислой среде при рН 1,5 - 2; при рН 3,4 - 5 окраска становится красно-пурпурной или пурпурной. В щелочной среде происходит изменение окраски: при рН 6,7 - 8 она становится синей, сине-зеленой, а при рН 9 — зеленой, переходящей в желтую при повышении рН до 10.
При исследовании свекольного сока в нем было обнаружено два пигмента: пурпурный и желтый. В процессе тепловой обработки пигменты разрушаются, причем пурпурный более интенсивно. В кислой среде пигменты свеклы сохраняются лучше. Поэтому при тушении свеклы добавляют уксусную или лимонную кислоту, а в некоторых случаях — томат-пюре, содержащий в значительном количестве лимонную кислоту.
Приборы, оборудование и материалы: рН-метр лабораторный; фотоэлектроколориметр; электроплитки; шесть стекол часовых; семь стаканов химических емкостью 200 мл; термометр; два стакана химических емкостью 100 мл; чашка фарфоровая диаметром 15 см; три пипетки градуированные емкостью 5 мл; восемь пробирок емкостью 20 мл; бикарбонат натрия в порошке; 10%-ный раствор уксусной кислоты; 4%-ный раствор уксусной кислоты; 0,1 н. раствор едкого натра; универсальная индикаторная бумага; синяя лакмусовая бумага.
Задание 1: продемонстрировать влияние реакции среды на изменение цвета вареного мяса.
Техника выполнения работы.
На технохимических весах отвесить шесть кусочков (кубиками) мяса весом по 50 г. Навески положить в химические стаканы, залить каждую 100 мл дистиллированной воды. Заготовить навески питьевой соды, равные 0,1; 0,3; 1,0; 2,0 и 10,0 г.
В стаканы № 2, 3, 4, 5 и 6 добавить навески соды. Стакан № 1 (без соды) служит контролем.
Подготовленные таким образом образцы мяса варить до готовности при слабом кипении в стаканах, накрытых часовыми стеклами (готовность определять проколом поварской иглы или вилкой). При выкипании бульонов добавлять горячую дистиллированную воду.
Отметить цвет кусочков вареного мяса и бульонов. Определить рН среды бульонов с помощью универсальной индикаторной бумаги. Для этого нанести на нее стеклянной палочкой каплю жидкости и сравнить полученную окраску с цветной шкалой.
Результаты оформить в виде таблицы 21.
Таблица 21 – Влияние реакции среды на изменение цвета вареного мяса
№ стакана |
Количество NaHCO3, г |
РН бульон
|
Цвет вареного мяса снаружи и на разрезе |
Цвет и прозрачность бульона |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Один из кусочков вареного мяса с аномальной окраской еще горячим переложить в стакан с горячей дистиллированной водой и приливать 10%-ный раствор СН3СООН до слабокислой реакции (проверить по синей лакмусовой бумаге).
Сделать выводы по заданию 1, обратив внимание на изменение цвета вареного мяса и бульона в зависимости от рН среды. Отметить влияние реакции среды на прозрачность бульона.
Задание 2: продемонстрировать влияние реакции среды на изменение окраски антоцианов.
Техника выполнения работы.
Для этой работы можно использовать соки окрашенных антоцианами плодов и ягод: вишневый, клюквенный, черносмородиновый, сливовый.
В два стакана налить по 5 мл сока. К содержимому одного стакана осторожно по каплям приливать 0,1 н. раствор едкого натра до отчетливого изменения естественной окраски. Отметить, какова окраска сока в первом и втором стаканах.
Затем определить рН среды соков с натуральной и измененной окраской. Для измерения реакции среды окрашенных жидкостей следует использовать лабораторный рН-метр. Объем жидкостей в стаканах можно увеличить, разбавив их дистиллированной водой (практически на рН среды не влияет увеличение объема в 10 раз).
В выводах по заданию 2 отметить величину рН, при котором изменяется окраска антоцианов.
Задание 3: продемонстрировать влияние реакции среды и концентрации пигментов свеклы на степень их разрушения при тепловой обработке.
Техника выполнения работы.
Очищенную свеклу натереть на терке, положить на марлю, сложенную вдвое, и отжать сок в стакан емкостью 100 мл.
В штатив поставить восемь пробирок и пронумеровать их. В четыре первых пробирки налить по 4 мл свекольного сока, в первую и вторую добавить по 1 мл дистиллированной воды, в третью и четвертую — по 1 мл 4%-ной уксусной кислоты. В четыре других пробирки внести по 2,5 мл свекольного сока, в пятую и шестую прилить по 2,5 мл воды, а в седьмую и восьмую — по 1 мл 4%-ного раствора уксусной кислоты и по 1,5 мл дистиллированной воды. Пробирки закрыть пробками и содержимое их тщательно перемешать.
Оставить в качестве эталонов пробирки № 1, 3, 5, 7, а № 2, 4, 6, 8 вместе со штативом поставить на кипящую водяную баню и нагревать при кипении в течение 20 мин. Вынуть пробирки из бани и охладить до комнатной температуры. Содержимое всех восьми пробирок перенести в мерные колбы емкостью 50 мл- Пробирки обмыть несколько раз небольшими порциями дистиллированной воды и слить промывные воды в соответствующие мерные колбы.
Содержимое колб довести до метки водой, тщательно перемешать и проколориметрировать все жидкости в фотоэлектроколориметре с синим светофильтром, в кювете с расстоянием между гранями 5 мм. Отсчет производить на правом барабане. В качестве контрольного раствора использовать дистиллированную воду.
Замер оптической плотности следует начинать с первого раствора. Если величина оптической плотности его будет более 0,5 следует использовать кювету с расстоянием между гранями 3 мм. В этой кювете колориметрируют все другие растворы.
Результаты работы оформить в виде диаграмм, отложив в масштабе величину оптической плотности исходного раствора и рядом — соответствующего прогретого раствора.
Сделать вывод по работе, отметив влияние концентрации и реакции среды на степень разрушения пигментов свеклы, учитывая, что между концентрацией вещества и оптической плотностью его растворов существует прямая зависимость.
Приложение 1
Учебное издание
«Основы сырья и продукции»
Методические указания
к выполнению лабораторных работ
для студентов специальности 1-27 01 01
«Экономика и организация производства
(по направлениям)»
Составитель: к.т.н., доцент Н.В. Абрамович
Рецензент к.т.н., доцент С.Л. Масанский
Редактор Бажанова Т.Л.
Технический редактор Щербакова А.А.
Подписано в печать ___________________ Печать офсетная. Усл. печ. л. ___________ Тираж ____ экз. ________ Заказ _________ ЛП №226 от 12.02.12003г. |
Формат 60х84 1/16 Уч. изд. л. _______ Бесплатно ЛИ № 02330/0131913 от 08.02.2007г. |
Отпечатано на ризографе МГУП 212027, Могилёв, пр-т Шмидта, 3 |
|