
- •Содержание
- •Часть I. Природный газ (пг) 9
- •Часть II. Сжиженный углеводородный газ (суг) 207
- •Часть I. Природный газ (пг)
- •1. Основные физические свойства природных газов
- •1.1. Горючие газы, используемые для газоснабжения
- •1.2. Основные физические свойства газов
- •Контрольные вопросы:
- •2. Основные сведения о газораспределительных системах
- •2.1. Общие понятия о газораспределительных системах
- •2.2. Классификация газопроводов
- •2.3. Системы газоснабжения
- •2.4. Потребители и режимы потребления газа
- •Контрольные вопросы:
- •3. Газораспределительные станции (грс)
- •3.1. Классификация и структура грс
- •3.2. Генплан и технологические схемы грс
- •Основные технические данные
- •3.3. Проектирование грс по узлам
- •3.3.1. Расчет узла редуцирования
- •3.3.2. Расчет узла очистки газа
- •3.3.3. Расчет узла предотвращения гидратообразования
- •3.3.4. Расчет узла учета количества газа
- •3.3.5. Расчет узла переключения
- •3.3.6. Расчет узла одоризации
- •3.3.7. Система автоматики и контрольно-измерительные приборы грс
- •3.4. Организация эксплуатации и обслуживания грс
- •3.4.1. Эксплуатация грс
- •3.4.2. Техническое обслуживание грс
- •3.4.3. Ремонт грс
- •3.4.4. Техническое диагностирование грс
- •Контрольные вопросы
- •4. Газорегуляторные пункты
- •4.1. Классификация и оборудование грп
- •Пункты газорегуляторные шкафные
- •Промышленные счетчики газа турбинные
- •Технические характеристики газовых фильтров грп
- •4.2. Регулирование давления на грс и грп
- •Принципиальное устройство регуляторов давления
- •4.3. Выбор оборудования грп, гру
- •4.3.1. Выбор регулятора давления
- •4.3.2. Выбор фильтра
- •4.4. Сезонное регулирование давления газа на выходе грп
- •5. Газовая распределительная сеть
- •5.1. Категории потребителей и режимы потребления газа
- •5.2. Расчетные расходы газа
- •5.2.1. Годовые расходы газа
- •5.2.2. Расчётные часовые расходы
- •5.3. Расчёт диаметра газопровода и допустимых потерь давления
- •5.4. Гидравлический расчёт простых газопроводов высокого, среднего и низкого давления
- •5.4.1. Газопроводы высокого и среднего давления
- •5.4.2. Газопроводы низкого давления
- •5.5. Методы расчёта тупиковой распределительной сети
- •5.5.1. Традиционный метод расчета тупиковой сети
- •5.5.2. Метод оптимальных диаметров
- •5.5.3. Комбинированный метод расчета тупиковой газораспределительной сети
- •5.5.4. Сравнительный анализ методик распределения расчетного перепада давления
- •5.6. Гидравлический расчёт кольцевых распределительных сетей Методика расчета кольцевых сетей
- •Методика гидравлической увязки кольцевой сети
- •5.7. Наружные газопроводы. Трубы и арматура
- •5.7.1. Пересечения газопроводов с различными препятствиями
- •5.9. Контрольная трубка с футляром:
- •5.7.2. Трубы и их соединения
- •5.7.3. Газовая арматура и оборудование
- •5.7.4. Приемка и ввод газопроводов в эксплуатацию
- •5.8. Внутренние устройства системы газораспределения
- •5.8.1. Устройство внутренних газопроводов
- •5.8.2..Бытовые газовые приборы
- •6. Хранилища природного газа и газозаправочные станции
- •6.1. Методы компенсации колебаний расхода газа
- •6.2. Газгольдеры
- •6.3. Аккумулирующая способность магистрального газопровода
- •6.4. Подземное хранение газа
- •6.4.1. Общие сведения по пхг
- •6.4.2. Общие требования
- •6.4.3. Организация эксплуатации
- •6.4.4. Техническое обслуживание и ремонт
- •Часть II. Сжиженный углеводородный газ (суг)
- •7. Общие сведения о сжиженных углеводородных газах
- •7.1. Компоненты суг
- •7.2. Маркировка и технические условия суг
- •7.3. Законы, константы и соотношения суг Законы идеального газа
- •Специфические особенности свойств сжиженных углеводородных газов (суг)
- •Отклонение реальных газов от идеального газа
- •8. Транспорт сжиженных углеводородных газов
- •8.1. Перевозка сжиженного газа автотранспортом
- •8.1.1. Перевозка сжиженных углеводородных газов в автоцистернах
- •8.2. Перевозка сжиженных газов по железным дорогам
- •8.2.1. Конструкция и техническая характеристика цистерн
- •8.2.2. Перевозка сжиженных газов по железным дорогам в крытых вагонах
- •Техническая характеристика цистерн, применяющихся за рубежом
- •8.3. Перевозка сжиженных углеводородных газов водным путем
- •8.3.1. Перевозка сжиженных углеводородных газов по морю
- •8.3.2. Перевозка сжиженных газов речным транспортом
- •8.4. Перевозка сжиженных углеводородных газов авиатранспортом
- •8.5. Транспортировка сжиженных углеводородных газов по трубопроводам
- •Контрольные вопросы:
- •9. Хранение сжиженных углеводородных газов
- •9.1. Способы хранения
- •9.1.1. Хранение при переменной температуре и высоком давлении
- •9.1.2. Хранение при постоянной температуре и низком давлении
- •9.2. Резервуары для хранения сжиженных углеводородных газов под давлением
- •9.2.1. Хранение сжиженных газов в стальных резервуарах под давлением
- •Допускаемый вакуум определяется из выражения
- •9.2.2. Подземные хранилища шахтного типа
- •9.2.3. Подземные хранилища в отложениях каменной соли
- •9.3. Эксплуатация подземных хранилищ в отложениях каменной соли
- •9.4. Низкотемпературное хранение сжиженных газов в наземных резервуарах
- •9.4.1. Конструкции низкотемпературных резервуаров
- •9.4.2. Низкотемпературное хранение сжиженных газов в подземных ледопородных резервуарах
- •9.5. Техническая и экономическая оценки существующих способов хранения сжиженных углеводородных газов
- •Контрольные вопросы:
- •10. Газонаполнительные станции сжиженных углеводородных газов
- •10.1. Назначение и размещение
- •10.2. Схемы и устройства гнс сжиженных газов
- •10.3. Типовые гнс сжиженных газов
- •10.4. Автоматизация и механизация процессов налива, слива и транспортировки баллонов
- •10.5. Характеристики насосов и компрессоров
- •10.6. Анализ методов перемещения сжиженных углеводородных газов
- •10.7. Использование сжиженных углеводородных газов в коммунально-бытовой газификации
- •10.7.1. Общие положения. Удельные расходы газа
- •10.7.2. Бытовые газобаллонные установки
- •Скобы …......……………………………………….. 2
- •Изоляция……………………………………...........8г
- •10.8. Заправка автомобилей сжиженными углеводородными газами
- •Контрольные вопросы:
- •11. Резервуарные и баллонные установки газоснабжения
- •11.1. Регазификация сжиженных углеводородных газов
- •11.1.1. Естественная регазификация
- •11.1.2. Искусственная регазификация
- •11.2. Резервуарные и баллонные установки с естественным и искусственным испарением [3, 10]
- •Список литературы
Специфические особенности свойств сжиженных углеводородных газов (суг)
При изменении величины давления или температуры все газы могут быть превращены в жидкость или из жидкости в пар. Для каждого газа существует определенная температура, выше которой, несмотря на применение любого высокого давления, он не может быть переведен в жидкое состояние. Эта температура называется критической, а давление, необходимое для сжижения газа при этой температуре, критическим. Иными словами, критическая температура чистых веществ – это та максимальная температура, при которой жидкая и паровая фазы еще могут существовать в равновесии. Давление паров при этой температуре называется критическим давлением, а объем единицы плотности вещества критическим объемом. Понятие о критической температуре впервые было предложено в 1861 г. Д. И. Менделеевым, который понимал под ней температуру, при которой исчезают силы сцепления между молекулами жидкости, и она, независимо от давления, превращается в газ. Приведенные выше определения критических параметров справедливы для индивидуальных газов. Технические газы в большинстве случаев представляют собой сложные смеси, критическая температура которых всегда выше критической температуры самого низкокипящего компонента и ниже критической температуры высококипящих компонентов. Критические параметры газовой смеси могут быть подсчитаны по правилу смешения (закону аддитивности), т.е. путем суммирования произведения абсолютных значений критического параметра отдельных компонентов, входящих в газовую смесь, на их мольную концентрацию:
![]() (7.44)
(7.44)
где Tкр1, …, Tкрn – критические температуры компонентов, входящих в газовую смесь; у1, …, уn – объемные или весовые концентрации компонентов газовой смеси в долях единицы.
Так же определяются и другие критические параметры. Подсчитанные по правилу смешения, критические параметры газовой смеси получили названия псевдокритических, или среднекритических.
Между среднекритическим давлением, среднекритической температурой и относительной плотностью того или иного газа существует зависимость. Отношение абсолютных значений физических констант вещества к их критическим параметрам получило название приведенных параметров.
![]() ,
(7.45)
,
(7.45)
![]() ,
(7.46)
,
(7.46)
![]() .
(7.47)
.
(7.47)
Эти уравнения были названы обобщенными уравнениями состояния.
Экспериментально было установлено, что все газы при одинаковых приведенных температурах и давлениях имеют одинаковый приведенный объем, т.е. приведенный объем газов есть функция приведенной температуры и приведенного давления:
Vпр = ƒ(Tпр;Pпр) (7.48)
Указанная выше закономерность получила наименование закона соответственных состояний.
Отклонение реальных газов от идеального газа
Законы газового состояния справедливы только для идеального газа. Следовательно, в технических расчетах, связанных с реальными углеводородными газами, законы для идеального газа применяют только в пределах давления до 0,2÷1,0 МПа (в зависимости от вида газа) и при температурах, превышающих 0ºС. При более высоких давлениях или более низких температурах либо применяют уравнения, учитывающие объем, занимаемый молекулами и силы взаимодействия между ними, либо вводят в уравнения для идеального газа опытные поправочные коэффициенты – коэффициенты сжимаемости газа.
Из множества уравнений газового состояния реальных газов наибольшее распространение получило уравнение Ван-дер-Ваальса:
(p + a/V) (V – b) = RT (7.49)
или для 1 моль газа (p+ a/V2)(Vм – b)= MRT, где а и b – константы, характерные для каждого газа. Величина a/V2 учитывает силы межмолекулярного взаимодействия, возрастающие с повышением давления до его определенного предела. Величина b учитывает собственный объем, занимаемый молекулами газа.
Уравнение Ван-дер-Ваальса дает результаты, совпадающие с практическими данными для газов с малой плотностью в широких диапазонах давлений и температур. Применение указанного уравнения к тяжелым углеводородам типа пропана, пропилена, н-бутана, бутилена и других может привести к ошибкам, достигающим 2÷10 % в зависимости от давлений и температур, при которых находится газ.
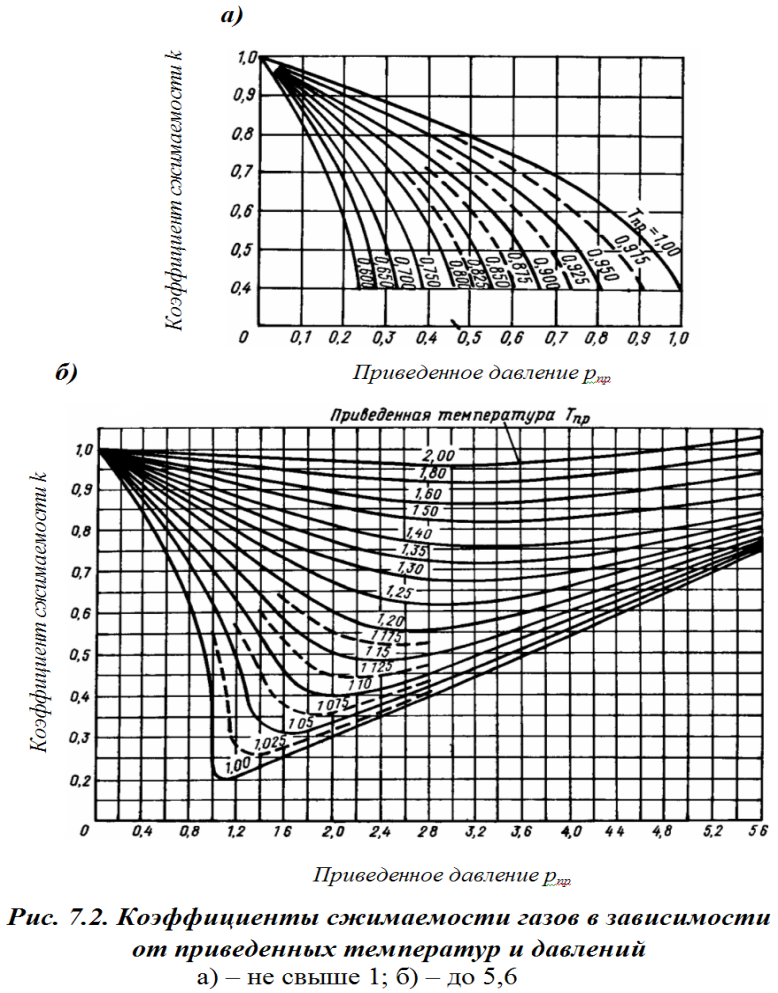
Рис. 7.1. Коэффициенты сжимаемости газов в зависимости от приведенных температур и давлении
а) не свыше 1; б) до 5,6
Учитывая изложенное, а также неудобство пользования этим уравнением в практических расчетах, применяют уравнения для идеального газа с введением в них экспериментально определенных поправок на сжимаемость. При введении таких поправок приведенные ранее уравнения принимают вид V=0,3708Vн(Т/p)z и ρ=2,6965ρн(p/T)(1/z) и pV = RTz, где z – коэффициент сжимаемости – безразмерная величина; индекс «н» говорит о нормальных условиях, т.е. 0ºС и 101,3 кПа.
Так как экспериментальных данных по сжимаемости углеводородных газов недостаточно, то коэффициенты сжимаемости обычно определяются по графикам (рис. 7.1), построенным по приведенным температурам и приведенным давлениям.
Для смесей газов пользуются среднекритическими параметрами, определенными по составу газа:
Pср.кр = Σ ri piкр; (7.50)
Tср.кр= Σ ri Tiкр, (7.51)
где ri – молярная (объемная) доля компонентов, входящих в смесь; piкр и Tiкр – критические давления и температуры отдельных компонентов.
Контрольные вопросы:
Какие газы относятся к сжиженным углеводородным газам?
Назовите маркировку сжиженного углеводородного газа согласно ГОСТ Р 52087 – 2003?
Каков компонентный состав СУГ в моторном топливе?
Каким законом описывается равновесное состояние фаз СУГ?
Особенности свойств СУГ?
