
- •Практичне заняття № 5
- •Мал. 3. Будова гема гемоглобіну
- •Пігменти крові
- •Транспорт газів кров'ю
- •Групи крові
- •Мал. 7. Макрофаг захоплює "чужі" еритроцити
- •Захисні системи організму. Імунітет
- •Мал. 8. Специфічний імунітет:
- •Система згортання крові
- •Протизгортальна система крові
- •Спрощена схема контуру регуляції лейкопоезу гранулоцитів/моноцитів
Е

Мал. 3. Будова гема гемоглобіну
ритропоез — це
складний процес, що регулюється комплексом
гуморальних факторів. Так, при крововтратах
або в умовах низької напруги кисню в
крові з'являється глікопротеїд
еритропоетин,
який стимулює
еритропоез. Ціанокобаламін (віт. В12)
та фолієва кислота (віт. Вс)
необхідні для синтезу глобіну та
дозрівання еритроцитів; вітаміни —
аскорбінова кислота (віт. С), рибофлавін
(віт. В2),
піридоксин (віт. В6)
та інші — контролюють синтез гема і
строми еритроцитів, при цьому
використовується залізо зруйнованих
еритроцитів.
Пігменти крові
Основна функція еритроцитів — транспорт газів крові: кисню і вуглекислого газу — здійснюється завдяки наявності в еритроцитах дихального пігменту крові гемоглобіну. Гемоглобін є хромопротеїдом — це речовина, що має колір і складається з білкової частини — глобіну та небілкової — гема. Цей пігмент містить у своєму складі атом феруму, розміщений у центрі молекули гема.
М
Мал. 4. Молекулярна
модель гемоглобіну:
а— молекули
гема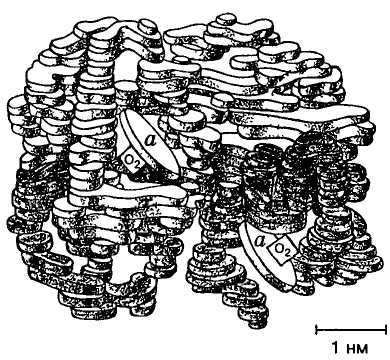
Поліпептидні ланцюги, що складаються кожний з 140-146 амінокислотних залишків, закручуючись у характерні α- та β-спіралі, утворюють близьку до сферичної фігуру діаметром 4—5 нм. Це і є молекула гемоглобіну. На її поверхні у спеціальних заглибленнях розміщені чотири молекули гема (мал. 4).
Транспорт газів кров'ю
Транспорт кисню. Кисень приєднується у молекулі гемоглобіну до атома феруму за допомогою слабких координаційних зв'язків, утворюючи оксигемоглобін (НbО2). Оскільки ферум при цьому не змінює валентності, то цей процес прийнято називати оксигенацією на відміну від окиснення, яке відбувається під впливом сильних окисників і супроводжується зміною валентності феруму до трьох. Внаслідок цього утворюється метгемоглобін (MetHb), який на відміну від оксигемоглобіну не здатний віддавати кисень. Оксигемоглобін, що віддав кисень, називають відновленим, або дезоксигемоглобіном (Нb). Ферум гема може приєднувати і карбону оксид — CO (чадний газ) — карбоксигемоглобін (НbСО).
Така сполука не здатна приєднувати кисень і транспортувати його до тканин, оскільки дисоціює з відщепленням СО у 200 разів повільніше, ніж оксигемоглобін. Тому наявність у повітрі навіть незначних концентрацій оксиду карбону є небезпечною для життя.
О
Мал. 5. Криві дисоціації
оксигемоглобіну при напрузі вуглекислого
газу в крові: 1
- 5,3 кПа (40 мм рт. ст ); 2 -
8 кПа (60 мм рт. ст.)
Приєднання кисню до гемоглобіну чи його відщеплення залежить насамперед від напруги кисню (рО2) в крові. Ця залежність нелінійна, описується S-подібною кривою — кривою дисоціації оксигемоглобіну (мал. 5). На осі абсцис графіка відкладено рО2 (у мм рт. ст.), ординат — ступінь насичення крові киснем (So2), яку виражають концентрацією НbО2 у відсотках за формулою
![]()
З малюнка видно, що при рО2 12-13,3 кПа (90-100 мм рт. ст.) (саме таким є парціальний тиск кисню в альвеолярному повітрі) насичення крові киснем досягає 94-96%. Повне 100% насичення може бути під час дихання сумішшю газів з високим вмістом кисню. Неповне насичення крові киснем за умов дихання повітрям пояснюють наявністю в крові невеликої кількості метгемоглобіну і тим, що частина крові в легенях проходить через шунти і не оксигенується. У міру зниження рО2 крива спочатку дуже повільно, а потім, починаючи з 6,5 кПа (50 мм рт. ст.), різко опускається, що свідчить про швидку дисоціацію оксигемоглобіну і віддачу ним кисню. Внаслідок виходу кисню з крові до тканин напруга кисню у венозній крові знижується до 4-5,3 кПа (30-40 мм рт. ст.). Венозна кров у легенях контактує з високим вмістом кисню в альвеолярному повітрі, насичуючись там киснем, стає артеріальною. Отже, основним чинником, що визначає хід реакції НЬ + О2 → НbО2, є напруга кисню в середовищі.
Варто зауважити, що хід кривої дисоціації оксигемоглобіну залежить від багатьох чинників, зокрема від температури крові, її рН, напруги вуглекислого газу (рСО2) у крові тощо. Проте більшість цих показників підтримується за нормальних умов на сталому рівні, і лише рСО2 крові змінюється під час проходження її через капіляри. Датський фізіолог Н. Бор установив, що за підвищення рСО2 в розчині з оксигемоглобіном крива дисоціації зміщується праворуч (див. мал. 5). Це явище дістало назву ефекту Бора. Отже, за однакового рівня рСО2, наприклад 5,3 кПа (40 мм рт. ст.), оксигемоглобін в артеріальній крові з низьким вмістом СО2 дисоціює на 24%, а в капілярах, де рСО2 вища, дисоціація оксигемоглобіну і віддача кисню в 1,5 раза більші. Отже, вуглекислий газ, вміст якого у капілярній крові зростає, прискорює віддачу кисню оксигемоглобіном. Протилежний процес — інтенсивна оксигенація гемоглобіну за рахунок зниження рСО2 — відбувається в легенях.
Переважна більшість біологічних реакцій, які в своїй основі є ферментативними, здійснюються за експоненційним чи гіперболічним законами. Тому S-подібний характер кривої дисоціації оксигемоглобіну довго не мав пояснення. Одна зі спроб пояснити це явище належить М. Едеру, який запропонував гіпотезу проміжних сполук. За цією гіпотезою, молекула гемоглобіну приєднує 4 молекули кисню в кілька етапів. Кожна наступна молекула кисню, сполучившись з гемоглобіном, послідовно змінює його властивості, рівновагу і швидкість наступної реакції. Те саме, тільки в зворотному порядку, має місце при дисоціації оксигемоглобіну. Згадана форма кривої дисоціації оксигемоглобіну свідчить про те, що зміни рО2 в альвеолах від 13,3 до 8 кПа (від 100 до 60 мм рт. ст.) мало впливають на насичення киснем артеріальної крові, а подальше зниження рО2 від 8 до 6,6-4 кПа (від 60 до 40—30 мм рт. ст.), що відбувається в процесі переходу крові до капілярного русла, призводить до швидкої дисоціації оксигемоглобіну і віддачі значної кількості кисню.
Рівнем SO2, що певною мірою характеризує всю криву дисоціації НЬО2, прийнято вважати рівень рО2, за якого гемоглобін насичується киснем на 50%. Для крові людини це 3,45 кПа (26 мм рт. ст.). Значна варіабельність цієї величини є проявом пристосування до життя в середовищах з різним вмістом кисню, і забезпечення необхідного рівня окисного метаболізму.
Хоча кисень приєднується до атома феруму гема, різна спорідненість гемоглобіну зумовлена не будовою гема, який у всіх гемоглобінів є однаковим, а глобіновою частиною пігменту, структурою та властивостями її ланцюгів, точніше, найближчим оточенням гема, тими амінокислотними радикалами, їхніми зарядами й полями, що вони створюють поблизу гема. Так, відомо, що гемоглобін плода людини (HbF) має вищу спорідненість до кисню, ніж гемоглобін дорослої людини (НЬА), і це пов'язано з тим, що HbF замість β-ланцюгів містить γ-ланщоги, які мають іншу послідовність амінокислот.
Т

Для розуміння подальших етапів перетворень СО2 слід мати на увазі, що:
1) в еритроциті, як і в будь-якій іншій клітині, йонів калію міститься значно більше, ніж у плазмі крові;
2) окиснений і відновлений гемоглобін та карбонатна кислота за своїми кислотними властивостями утворюють ряд: НЬО2>Н2СО3>НЬ. Тому НЬО2 як відносно сильна кислота приєднує до себе метал — йон калію. Отже, в еритроциті, що з кров'ю був принесений до тканин, одночасно відбуваються два процеси: один — утворення карбонатної кислоти і другий — дисоціація оксигемоглобіну:
КНЬО2 → КНЬ + О2.
Карбонатна кислота є сильнішою, ніж дезоксигемоглобін, і тому вона відбирає у нього К+, утворюючи при цьому добре дисоційовану сіль калію гідрогенкарбонат:
Н2СО3 + КНЬ → КНСО3 + ННЬ.
Упродовж цього процесу відбувається накопичення в еритроциті гідрогенкарбонату (НСО-3) і дифузія його в плазму крові (згадаймо, що мембрана еритроцита добре проникна для аніонів і важко — для катіонів). Одночасно з виходом з еритроцита НСО-3 для компенсації порушеної йонної рівноваги в еритроцит надходить із плазми крові відповідна кількість йонів хлору (мал. 6, а). Слід підкреслити, що вуглекислий газ на відміну від кисню та карбону оксиду (чадного газу) ніколи не вступає в реакцію з атомом феруму в молекулі гема. Деяка частина вуглекислого газу зв'язується з аміногрупами глобіну, утворюючи карбгемоглобін (HbNH2 + СО2 → Hb NHCOOH), який транспортує вуглекислий газ до легень.
Я
Мал. 6. Транспорт вуглекислого
газу кров'ю: а — у тканинах, б
— у легенях
—розчиненого газу в плазмі крові — 10%;
калію гідрогенкарбонату (КНСО3) еритроцитів — 35%;
натрію гідрогенкарбонату (NaHCO3) плазми крові — 45%;
карбгемоглобіну еритроцитів — 10%.
У легенях процеси віддачі вуглекислого газу відбуваються у зворотному порядку (мал. 6, б):
ННb + О2 → ННbО2;
ННbО2 + КНСО3 → КНbО2 + Н2СО3.
Утворювана карбонатна кислота швидко гідролізується вугільною ангідразою, яка змінює напрямок каталізованої нею реакції залежно від рН середовища:
![]()
Вуглекислий газ дифундує з еритроцитів у плазму крові, далі в альвеоли і виходить з легень. У міру зниження в еритроциті концентрації НСО3- їх кількість поповнюється з плазми, при цьому одночасно з еритроцита в плазму переходить відповідна кількість йонів хлору. Процес повторюється до вилучення з крові зайвого вуглекислого газу і насичення її киснем (артеріалізації).
Досі йшлося про так званий обмінний вуглекислий газ, тобто ту фракцію
Таблиця 2. Гази крові Показники Примітка. 1 мм рт. ст. = 0,133 кПа.
|
Значення показників у крові |
|
артеріальній |
венозній |
|
Напруга кисню (рО2), мм рт. ст |
90-100 |
30-40 |
Об'ємна частка кисню, % (об. %) |
18-20 |
12-14 |
Насичення крові киснем (SO2), % |
94-96 |
50-70 |
Напруга вуглекислого газу (рСО2), мм рт. ст. |
40 |
46 |
Об'ємна частка вуглекислого газу, % (об. %) |
50 |
56 |
Кількісну характеристику показників газового складу артеріальної та венозної крові наведено у табл. 2. Як видно з таблиці, вміст вуглекислого газу в крові залежить від його напруги (рСО2) в ній, і в принципі цю залежність можна виразити у вигляді кривої, аналогічної до кривої дисоціації оксигемоглобіну. Тільки крива зв'язування СО2 не має S-подібної форми і 100% насичення. У міру збільшення рСО2 утворення гідрогенкарбонатів, а отже, і вміст вуглекислого газу в крові можуть зростати необмежено. Проте крива зв'язування СО2 виявляє ефект, аналогічний ефекту Бора для кривої дисоціації НbО2, а саме: зменшення оксигенації крові зумовлює збільшення вмісту вуглекислого газу в ній переважно за рахунок зростання концентрації карбгемоглобіну. Це явище дістало назву ефекту Христіансена —Дугласа — Холдейна. Його біологічне значения полягає в тому, що віддача кисню артеріальною кров'ю в капілярах тканин сприяє повнішому захопленню і виведенню з них вуглекислого газу, так само як зростання рСО2 крові в капілярах тканин прискорює дисоціацію НЬО2 і віддачу їм кисню. У легенях цей процес відбувається у зворотному напрямку.
