
- •Міністерство інфраструктури та зв’язку україни
- •Лабораторна робота 50 Визначення сталої в законі Стефана – Больцмана
- •Теоретичні відомості
- •Закони теплового випромінювання
- •П орядок виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота 60 Градуювання шкали спектроскопа та вимірювання довжин хвиль спектрів випромінювання газів
- •Теоретичні відомості
- •Порядок виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота 61 Квантовий генератор випромінювання оптичного діапазону
- •Теоретичні відомості
- •П ринцип роботи газового лазера
- •3. Система накачки.
- •Порядок виконання роботи
- •Порядок виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота 63 Визначення сталої Планка за допомогою фотоелемента
- •Теоретичні відомості
- •Основні закони зовнішнього фотоефекту
- •Метод визначення
- •Порядок виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота 64 Визначення енергетичних станів атомів
- •Теоретичні відомості
- •Опис приладу та методу вимірювання
- •Порядок виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота № 66 Вивчення тунельного ефекту
- •Теоретичні дані
- •Порядок виконання роботи
- •Порядок виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота № 68 Дослідження вольт-амперної характеристики р - n переходу
- •Теоретичні дані
- •Порядок виконання роботи
- •Контрольні питання
- •Лабораторна робота № 69 Вивчення внутрішнього фотоефекту
- •Теоретичні дані
- •Порядок виконання роботи
- •Контрольні питання та завдання
- •Методичні вказівки до лабораторного практикуму з фізики атомів та квантової оптики
- •49010, Дніпропетровськ, вул. Лазаряна, 2
Теоретичні відомості
Д искретність
енергії являється важливішою властивістю
мікрочастинок. Атоми можна уявити у
вигляді маленької скриньки, в якому
знаходяться ядро і електрони. Внаслідок
хвильової природи електрони повинні
поводити себе в атомі подібно стоячим
звуковим хвилям в обмеженому об'ємі.
Рух електронів в атомі описується
рівнянням Шредінгера.
искретність
енергії являється важливішою властивістю
мікрочастинок. Атоми можна уявити у
вигляді маленької скриньки, в якому
знаходяться ядро і електрони. Внаслідок
хвильової природи електрони повинні
поводити себе в атомі подібно стоячим
звуковим хвилям в обмеженому об'ємі.
Рух електронів в атомі описується
рівнянням Шредінгера.

де
![]() ;
;
![]() – повна
енергія;
– повна
енергія;
U — потенціальна енергія електрона.
Рівняння Шредінгера дає можливість знайти значення енергії електрона в атомі в стаціонарних станах. Задача спрощується для воднеподібних атомів, де вважається, що енергетичний стан електрона описується моделлю потенціальної ями, зображеної на рис.1.
Залежність потенціалу від радіуса атома виражається функцією

Після підстановки значення потенціальної енергії в рівняння Шредінгера маємо

Для спрощення рішення цього рівняння в подальшому будемо вважати, що електронна хвиля в атомі не трьохмірна, якою вона є в дійсності, а одномірна, яка розповсюджується вздовж діаметра атома, тобто

Стоячій хвилі в атомі можна приписати наближене значення, кратне діаметру, тобто
![]() де
де
![]()
Користуючись формулою де–Бройля:

та виразом

Одержимо
![]() або, приводячи до квадрата і розв’язуючи
відносно D, маємо:
або, приводячи до квадрата і розв’язуючи
відносно D, маємо:
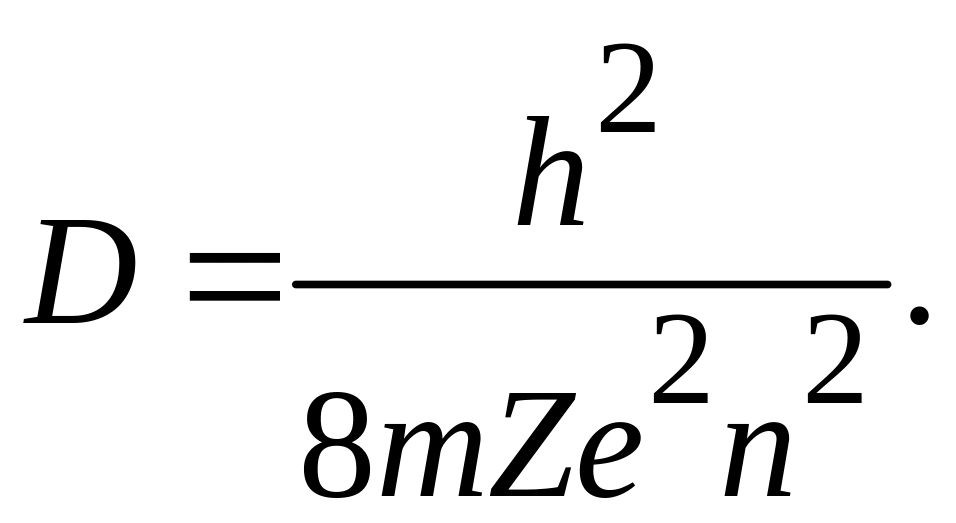 (1)
(1)
Значення енергії атома в стаціонарному стані n знайдемо із умови

Використовуючи
наближене значення
![]() маємо:
маємо:

Підставляючи сюди отриманий вираз (1) для діаметра атома, знайдемо:

що з точністю до постійного множника узгоджується з виразом для енергії, який був отриманий у більш строгій теорії:
 (2)
(2)
Для енергії атома в іншому стаціонарному стані, що визначається головним квантовим числом k, маємо подібний вираз:
 (3)
(3)
Щоб електрон зміг перейти із одного енергетичного стану в інший, атом, згідно постулату Бора повинен поглинати означення порцій енергії:

 ,
,
де
 – стала Рідберга;
– стала Рідберга;
![]() і
–
номери орбіт електрона в атомі.
і
–
номери орбіт електрона в атомі.
Експериментальне підтвердження дискретності енергетичних рівнів атомів ртуті було приведено Франком та Герцом в 1913р.
Опис приладу та методу вимірювання
В даній роботі замість парів ртуті
використовується газ ксенон, яким
заповнюють балон тиратрона. Енергію
атома ксенону передають електрони,
емітовані нагрітим катодом (рис. 2).
даній роботі замість парів ртуті
використовується газ ксенон, яким
заповнюють балон тиратрона. Енергію
атома ксенону передають електрони,
емітовані нагрітим катодом (рис. 2).
Енергія електронів може змінюватися за допомогою сітки, потенціал якої залежить від положення двигунка потенціометра.
Нехай
прискорююча різниця потенціалів рівна
U.
Тоді
робота, що виконується електричним
полем лампи по переміщенню кінетичну
енергію
електрона, дорівнює,
![]() і
електрон набуде
і
електрон набуде
![]() .
.
Найменша різниця потенціалів між катодом і сіткою, достатня для придбання енергії збудження атома, називається першим потенціалом збудження . Атом ксенону після зіткнення з електроном перейде в другий енергетичний стан, а сила анодного струму внаслідок непружного зіткнення електрона зменшиться.
Д ля
знаходження потенціалу збудження
використовується метод затримуючого
потенціалу. До анода тиратрона подають
невеликий постійний відносно сітки,
потенціал за допомогою елемента
ля
знаходження потенціалу збудження
використовується метод затримуючого
потенціалу. До анода тиратрона подають
невеликий постійний відносно сітки,
потенціал за допомогою елемента
![]() .
Електрони, які емітовані нагрітим
катодом, набувають енергію в полі катод
– сітка і , долаючи потенціальний бар’єр
негативно зарядженої сітки, збираються
анодом і йдуть через мікроамперметр.
.
Електрони, які емітовані нагрітим
катодом, набувають енергію в полі катод
– сітка і , долаючи потенціальний бар’єр
негативно зарядженої сітки, збираються
анодом і йдуть через мікроамперметр.
При
напругах між анодом і сіткою
![]() зіткнення електронів з атомами ксенону
будуть пружними і струм в анодному колі
змінюватися не буде. При досягненні
потенціалу на сітці
зіткнення
стануть непружніми, анодний струм різко
зменшується. При подальшому збільшенні
різниці потенціалів між сіткою і катодом
кінетична енергія електронів збільшується,
здійснюються знову пружні зіткнення ,
струм у анодному колі знову зростає.
Так буде продовжуватися , доки
не досягне значення, рівного
зіткнення електронів з атомами ксенону
будуть пружними і струм в анодному колі
змінюватися не буде. При досягненні
потенціалу на сітці
зіткнення
стануть непружніми, анодний струм різко
зменшується. При подальшому збільшенні
різниці потенціалів між сіткою і катодом
кінетична енергія електронів збільшується,
здійснюються знову пружні зіткнення ,
струм у анодному колі знову зростає.
Так буде продовжуватися , доки
не досягне значення, рівного
![]() .
.
Коли різниця потенціалів стане у два рази більше першого потенціалу збудження атомів ксенону анодний струм знову зменшиться. Залежність анодного струму від напруги буде мати вигляд, зображений на рис. 3. З графіка можна знайти потенціал збудження.
