
- •1. Общий порядок оформления работ по синтезу органических соединений
- •2. Порядок заполнения таблицы «Расчет синтеза»
- •3. Порядок заполнения таблицы «Сводная таблица результатов синтеза»
- •4. Галогенирование
- •4.1. Бромистый этил (бромэтан)
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция галогенпроизводных
- •Контрольные вопросы
- •4.2. Бромистый бутил (1-бромбутан)
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция галогенпроизводных
- •Контрольные вопросы
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция галогенпроизводных
- •Контрольные вопросы и задания
- •5. Нитрование
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •5.2. Нитрометан
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •6. Сульфирование
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •6.3. Сульфаниловая кислота
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •7. Ацилирование
- •7.1. Ацетанилид
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •7.2. Аспирин (о-ацетоксибензойная кислота)
- •Посуда и приборы
- •Методика синтеза
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •7.4. Этилформиат
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Контрольные вопросы
- •Посуда и приборы
- •Методика синтеза
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •9. Диазотирование
- •9.1. Фенол
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •9.2. Йодбензол
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •10. Красители
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Контрольные вопросы
- •10.2. Метиловый оранжевый
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •10.3. Малахитовый зеленый
- •Посуда и приборы
- •Химизм получения малахитового зеленого
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •10.4. Фенолфталеин
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •10.5. Флуоресцеин
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •11. Щелочное плавление
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •12. Реакции Канниццаро
- •12.1. Бензойная кислота и бензиловый спирт
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •12.2. Бензиловый спирт
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •13. Окисление
- •13.1. Ацетон
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •Библиографический список
- •Лабораторный практикум по органическому синтезу
- •1 70026, Тверь, наб. Афанасия Никитина, 22
Методика синтеза
В стакане емкостью 400 мл, снабженном механической мешалкой (рис. 42), растворяют 2,5 г сульфаниловой кислоты в 65 мл 2н раствора гидроксида натрия и к полученному раствору соли прибавляют раствор 1 г нитрита натрия в 12 мл воды. Затем реакционную смесь охлаждают до 10С и при перемешивании постепенно вносят 4н раствор соляной кислоты до прекращения образования осадка. Полученную смесь п-диазобензолсульфокислоты при комнатной температуре быстро при перемешивании приливают к щелочному раствору -нафтола, приготовленному отдельно в стакане емкостью 600 мл (2 г -нафтола в 25 мл 2н гидроксида натрия).

Рис. 42. Прибор для синтеза -нафтолоранжа:
1, 7 – стакан; 2 – баня ледяная; 3 – мешалка механическая; 4 – пробка резиновая; 5 – термометр; 6 – штатив
Через несколько минут начинается кристаллизация оранжево-красных листочков красителя (натриевой соли). Для уменьшения растворимости красителя прибавляют 12 г хлорида натрия. Смесь охлаждают и фильтруют (см. рис. 15). Продукт реакции промывают на фильтре холодной водой.
Получают 4 г красителя.
Физические свойства
-Нафтолоранж (кислотный оранжевый, оранж II, п-(2-гидрокси-1-нафтилазо) бензолсульфокислый натрий)) – кристаллическое вещество ярко-оранжевого цвета, хорошо растворимое в воде:
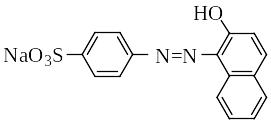
Молярная масса 350,34.
Благодаря яркости оттенка и довольно хорошей прочности этот краситель имеет практическое применение.
Контрольные вопросы
1. Перечислить основные реакции, лежащие в основе процесса получения β-нафтолоранжа [33, 35, 37].
2. Перечислить основные стадии получения β-нафтолоранжа.
3. Указать особенности реакции диазотирования: а) соотношения реагентов; б) температуры; в) рН среды; г) контроль содержания азотистой кислоты [33, 35, 37].
4. Охарактеризовать химические свойства диазосоединений: а) реакции с выделением азота; б) реакции без выделения азота.
5. Указать особенности реакции азосочетания: механизм, условия проведения.
6. Охарактеризовать химические свойства ароматических азосоединений на примере β-нафтолоранжа [1].
7. На примере получения β-нафтолоранжа указать диазо- и азосоставляющие [1].
8. Сформулировать основные положения «теории цветности».
10.2. Метиловый оранжевый
Количества химических реактивов для синтеза метилового оранжевого и вспомогательных материалов указаны в табл. 22.
Таблица 22. Вещества, принимающие участие в реакции синтеза метилового оранжевого, и вспомогательные материалы
Реактив |
Плотность, г/см3 |
Концентрация, % |
Количество |
|
г |
мл |
|||
Раствор № 1: сульфаниловая кислота |
– |
99,5 |
5 |
– |
натрий гидроксид 2Н |
– |
98,5 |
– |
12 |
натрий азотистокислый |
– |
99,0 |
2 |
– |
соляная кислота 2Н |
1,190 |
[29] |
– |
12 |
вода дистиллированная |
1,000 |
– |
– |
24 |
Раствор № 2: N,N-Диметиланилин |
0,956 |
99,0 |
5 |
рассчитать |
соляная кислота 1Н |
1,190 |
[29] |
– |
50 |
натрий гидроксид 2Н |
– |
98,5 |
– |
до щелочной реакции |
Примечание. Перед началом синтеза уточнить концентрации имеющихся в лаборатории реактивов.
