
- •1. Общий порядок оформления работ по синтезу органических соединений
- •2. Порядок заполнения таблицы «Расчет синтеза»
- •3. Порядок заполнения таблицы «Сводная таблица результатов синтеза»
- •4. Галогенирование
- •4.1. Бромистый этил (бромэтан)
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция галогенпроизводных
- •Контрольные вопросы
- •4.2. Бромистый бутил (1-бромбутан)
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция галогенпроизводных
- •Контрольные вопросы
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция галогенпроизводных
- •Контрольные вопросы и задания
- •5. Нитрование
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •5.2. Нитрометан
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •6. Сульфирование
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •6.3. Сульфаниловая кислота
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •7. Ацилирование
- •7.1. Ацетанилид
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •7.2. Аспирин (о-ацетоксибензойная кислота)
- •Посуда и приборы
- •Методика синтеза
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •7.4. Этилформиат
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Контрольные вопросы
- •Посуда и приборы
- •Методика синтеза
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •9. Диазотирование
- •9.1. Фенол
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •9.2. Йодбензол
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •10. Красители
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Контрольные вопросы
- •10.2. Метиловый оранжевый
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •10.3. Малахитовый зеленый
- •Посуда и приборы
- •Химизм получения малахитового зеленого
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •10.4. Фенолфталеин
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •10.5. Флуоресцеин
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •11. Щелочное плавление
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительная реакция
- •Контрольные вопросы
- •12. Реакции Канниццаро
- •12.1. Бензойная кислота и бензиловый спирт
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •12.2. Бензиловый спирт
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •13. Окисление
- •13.1. Ацетон
- •Посуда и приборы
- •Методика синтеза
- •Физические свойства
- •Отличительные реакции
- •Контрольные вопросы
- •Библиографический список
- •Лабораторный практикум по органическому синтезу
- •1 70026, Тверь, наб. Афанасия Никитина, 22
-
Министерство образования и науки РФ
Тверской государственный технический университет
Е.И. Лагусева, Г.А. Масленникова
Лабораторный практикум
по органическому синтезу
Учебное пособие
Издание первое
Тверь 2011
УДК 547(075.8)
Б БК
24.2я7
БК
24.2я7
Лагусева, Е.И. Лабораторный практикум по органическому синтезу: учебное пособие / Е.И. Лагусева, Г.А. Масленникова. Тверь: ТвГТУ, 2011. 108 с.
Содержит описания выполнения синтезов различных органических соединений. Синтезы классифицированы по методам органической химии.
Подробное и последовательное изложение методик проведения синтезов органических соединений позволяет студентам уменьшить затраты времени на самостоятельную подготовку к лабораторным занятиям.
Предназначено для студентов дневной формы обучения по дисциплине «Органическая химия» направлений 020100 Химия, 240100 Химическая технология, 240700 Биотехнология, 240100 Химическая технология и биотехнология, специальности 240901 Биотехнология и для студентов заочной формы обучения специальности 280201 Охрана окружающей среды, направлениям 241000 Энергоресурсосберегающие процессы химической технологии, нефтехимии и биотехнологии, 240700 Биотехнология, 270800 Строительство.
Рецензенты: зав. кафедрой органической химии Тверского государственного университета, заслуженный химик РФ, доктор химических наук, профессор Ворончихина Л.И.; профессор кафедры физической химии Тверского государственного университета, доктор химических наук, профессор Пахомов П.М.
ISBN 978-5-7995-0585-1 |
Тверской государственный технический университет, 2011 Лагусева Е.И., Масленникова Г.А., 2011 |
ОГЛАВЛЕНИЕ
1. ОБЩИЙ ПОРЯДОК ОФОРМЛЕНИЯ РАБОТ ПО СИНТЕЗУ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 4
2. Порядок заполнения таблицы «Расчет синтеза» 5
3. Порядок заполнения таблицы «Сводная таблица результатов синтеза» 9
4. Галогенирование 11
4.1. Бромистый этил (бромэтан) 11
4.2. Бромистый бутил (1-бромбутан) 16
4.3. -Бромнафталин 21
5. Нитрование 27
5.1. о- и п-Нитрофенолы 27
5.2. Нитрометан 33
5.3. -Нитронафталин 37
6. Сульфирование 42
6.1. -Нафталинсульфокислота, натриевая соль 42
6.2. п-Толуолсульфокислота, натриевая соль 46
6.3. Сульфаниловая кислота 50
7. Ацилирование 55
7.1. Ацетанилид 55
7.2. Аспирин (о-ацетоксибензойная кислота) 58
7.3. Изоамилацетат 60
7.4. Этилформиат 66
7.5. -Нафтилацетат 68
8. Ацилирование 70
8.1. Анилин 70
8.2. -Нафтиламин солянокислый 76
9. Диазотирование 79
9.1. Фенол 79
9.2. Йодбензол 84
10. Красители 87
10.1. -Нафтолоранж 87
10.2. Метиловый оранжевый 89
10.3. Малахитовый зеленый 92
10.4. Фенолфталеин 96
10.5. Флуоресцеин 98
11. Щелочное плавление 102
11.1. -Нафтол 102
12. Реакции Канниццаро 105
12.1. Бензойная кислота и бензиловый спирт 105
12.2. Бензиловый спирт 107
13. Окисление 109
13.1. Ацетон 109
Библиографический список 112
1. Общий порядок оформления работ по синтезу органических соединений
В отчете указывается:
1. Название синтеза.
2. Дата начала и окончания работы.
3. Использованные литературные источники.
4. Уравнения реакций [l–11]: а) получения синтезируемого вещества; б) происходящих при очистке; в) побочных, с указанием условий, способствующих их протеканию.
5. Механизм основных реакций [l–11].
6. Расчет и заполнение табл. 1 (см. порядок заполнения таблицы).
7. Заполнение в табл. 2 названия и формулы полученного вещества (графа 1), молярной массы и констант (температуры плавления tпл, температуры кипения tкип, показателя преломления n420; плотности d420; температуры вспышки tвспышки, температуры самовоспламенения tсамовоспламенения, растворимости) по литературным данным (графы 2, 3).
8. В рабочей тетради: а) физиологическое воздействие всех исходных, промежуточных и конечных веществ на организм человека [16–19], б) предельно допустимые концентрации применяемых при проведении синтеза вредных веществ в воздухе рабочей зоны [21]; в) класс опасности веществ [20–22]; г) наиболее опасные моменты при проведении синтеза и меры предосторожности при работе с исходными и конечными веществами, согласно правилам техники безопасности, а также первая помощь при ожогах и отравлениях [16–19].
9. Рисунки приборов для проведения синтеза и очистки получаемого вещества.
10. Методика проведения синтеза и очистки получаемого вещества.
11. Протокол выполнения синтеза.
12. Масса полученного вещества.
-
Пример записи:
масса вещества с колбой
масса колбы
масса вещества
13. Расчет выхода полученного вещества в процентах от теории и от указанного в методике синтеза.
14. Определение констант полученного вещества по ГОСТ: для жидкостей – показателя преломления [23] и температуры кипения по [24], для твердых веществ – интервала температуры плавления [25].
2. Порядок заполнения таблицы «Расчет синтеза»
1. В графе 1 указываются все вещества, упомянутые в методике.
2. Графы 2 и 3 заполняются по данным [13, т. 2, 4; 14] (для твердого вещества показатель преломления не указывается). Молярная масса указывается с точностью до двух знаков после запятой, плотность – при комнатной температуре (20°С).
3.
Для графы 4 выписать концентрацию
используемых реактивов из списка,
имеющегося в лаборатории; для кислот в
графу 3 «концентрация» таблицы 1
выписывается плотность имеющейся в
лаборатории кислоты, затем по таблице
плотностей растворов находят концентрацию
кислоты [29]. В связи с тем, что большинство
методик составлялось с применением
соляной кислоты плотности
![]() =1,19,
т.е. 37,23%, а в лаборатории она может быть
другой концентрации, то во всех методиках
с использованием соляной кислоты
указанный объем соляной кислоты
необходимо умножить на коэффициент К:
=1,19,
т.е. 37,23%, а в лаборатории она может быть
другой концентрации, то во всех методиках
с использованием соляной кислоты
указанный объем соляной кислоты
необходимо умножить на коэффициент К:
![]()
В том случае, когда в таблице для данной плотности точного значения концентрации нет, она рассчитывается.
Пример
расчета.
Имеется соляная кислота
![]() =1,163.
=1,163.
Значения таблицы: =1,160, =1,165.
Расчет процентной концентрации кислоты с плотностью 1,163:
![]()
4. Расчет количества веществ может производиться по заданному коэффициенту или по числу молей исходного вещества.
4.1. При заданном преподавателем коэффициенте количество веществ, указанных в литературном источнике (в граммах или миллилитрах) умножается на заданный коэффициент. Для жидкостей заполняются графы 8 и 9, для твердых веществ – графа 8 (см. температуру плавления вещества). По числу граммов вещества заданной процентной концентрации (графа 8) рассчитывается содержание основного вещества реактива (без примесей) и вписывается в графу 7.
Пример. Концентрация серной кислоты H2SO4 – 90%, масса – 150 г.
В 100 г H2SO4 заданной концентрации содержится 90 г H2SO4,
в 150 г H2SO4 заданной концентрации содержится X г H2SO4.
![]()
Таким образом, в 150 г заданной концентрации серной кислоты содержится 135 г основного вещества (серной кислоты) без примесей.
-
КОЛИЧЕСТВА ВЕЩЕСТВ
Избыток
%
11
моль
10
Требуется
по методике
в данной концентрации
мл
9
г
8
содержание основного вещества, %
7
моль
6
по теории, моль
5
И
 СХОДНЫЕ
ВЕЩЕСТВА
СХОДНЫЕ
ВЕЩЕСТВАКонцен-трация,
%
4
Константы:
– tпл, оС;
– tкип, оС;
– n420;
– d420;
– tвспышки, оС;
– tсамовоспламенения, оС;
– растворимость
3
Моля-рная масса
2
Название и формулы веществ
1
а) принимаю-щих участие в реакциях
б) применяе-мых при очи-стке вещества
в) раствори-телей
Для графы 6 число молей вещества рассчитывается по данным граф 2 и 7.
Данные графы 5 рассчитываются с учетом коэффициентов уравнения реакции. Число молей веществ графы 6 делится на коэффициенты уравнения реакции, находится наименьшее значение, и оно принимается за единицу. Далее это наименьшее число умножается на коэффициенты уравнения реакции и результаты проставляются в графу 5. Например, в синтезе анилина:
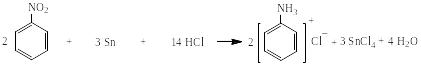
(1)
«а» молей «б» молей «в» молей (по методике)
а/2 б/3 в/14
Например, наименьшее число получается а/2.
Для графы 5 получаем значения цифр следующим образом:
нитробензол . . . . . . . (а/2) х 2;
олово . . . . . . . . . . . . . (а/2) х 3;
соляная кислота . . . . (а/2) х 14.
Из цифр граф 5, 6 вычисляют данные графы 10 и затем рассчитывают графу 11. Число молей для каждого вещества по теории принимается за 100%, а число молей в графе «избыток» – за Х%.
4.2. По заданному числу молей одного из исходных веществ. Графы 1, 2, 3, 4 заполняются аналогично предыдущему способу расчета. Заданное число молей указанного вещества записывается в графу 6. Это число умножается на молярную массу, и результат проставляется в графу 7. По графам 4 и 7 таблицы 1 находится количество вещества данной концентрации в граммах (графа 8), для жидкостей – в граммах и миллилитрах (графа 8, 9). Далее рассчитывается количество всех остальных реактивов, применяемых в синтезе. Для этого берутся данные из методики синтеза и составляется пропорция.
Пример. В синтезе анилина по проведенному расчету в графе 8 получили 17,5 г нитробензола; по методике – 18,5 г; олова по методике – 36 г. Составляем пропорцию:
1![]() 8,5
г – 36 г
8,5
г – 36 г
17,5 г – X г
34,05 г олова записывается в графу 8, и далее расчет ведется как в пункте 4.1.
