
Лабораторная работа №5 спектр свечения щелочных металлов (натрия)
Цель работы: 1. Изучить спектр свечения атомов натрия в видимой области и тонкую (дублетную) структуру спектральных линий.
2. Произвести экспериментальную проверку правильности описания энергетического положения наблюдаемых спектральных линий с помощью модифицированной формулы Бальмера и табличных значений соответствующих ридберговских поправок.
3. Оценить величину тонкого расщепления спектральных линий и постоянной тонкой структуры.
Введение
Спектры испускания атомов щелочных металлов, подобно спектру водорода, состоят из нескольких серий линий. Наиболее интенсивные из них получили названия: главная, резкая, диффузная и основная (или серия Бергмана). Эти названия имеют следующее происхождение. Главная серия названа так потому, что наблюдается и при поглощении. Следовательно, она соответствует переходам атома в основное состояние. Резкая и диффузная серии состоят соответственно из резких и размытых (диффузных) линий. Серия Бергмана была названа основной (фундаментальной) за свое сходство с сериями водорода.
Л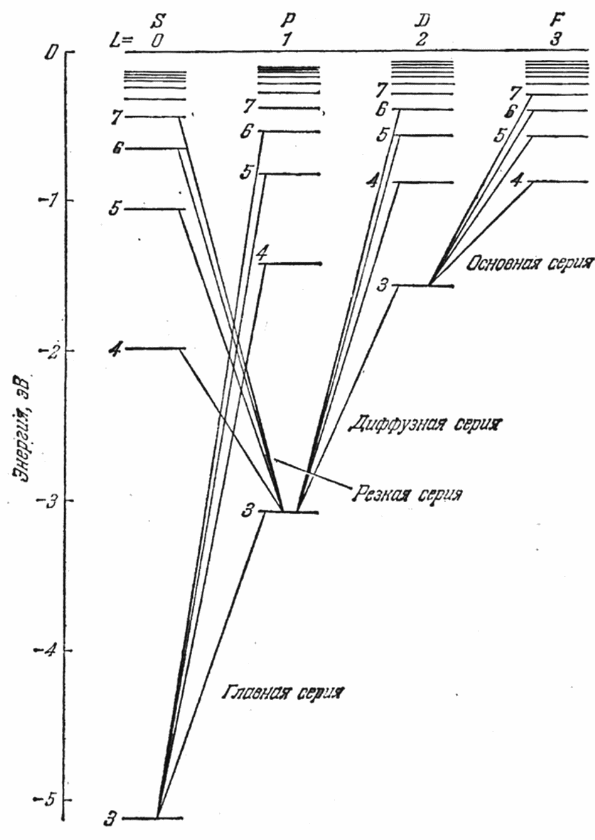 инии
серий атома Na можно представить как
переходы между энергетическими уровнями,
изображенными на рис.1. Эта схема
отличается от схемы уровней водородного
атома (см. работу № 4) тем, что аналогичные
уровни в различных рядах лежат на
неодинаковой высоте. Несмотря на это
отличие, обе схемы обнаруживают большое
сходство. Это сходство дает основание
предположить, что спектры щелочных
металлов испускаются при переходах
самого внешнего (так называемого
валентного или оптического) электрона
с одного уровня на другой.
инии
серий атома Na можно представить как
переходы между энергетическими уровнями,
изображенными на рис.1. Эта схема
отличается от схемы уровней водородного
атома (см. работу № 4) тем, что аналогичные
уровни в различных рядах лежат на
неодинаковой высоте. Несмотря на это
отличие, обе схемы обнаруживают большое
сходство. Это сходство дает основание
предположить, что спектры щелочных
металлов испускаются при переходах
самого внешнего (так называемого
валентного или оптического) электрона
с одного уровня на другой.
Из рис.1 видно, что энергия состояния оказывается зависящей, кроме квантового числа n, также от того, в какой ряд попадает данный терм, т. е. от номера ряда термов. На схеме уровней атома водорода различные ряды термов (с совпадающими по высоте уровнями) отличаются значениями момента импульса электрона. Естественно предположить, что различные ряды термов щелочных металлов также отличаются значениями момента импульса валентного электрона. Поскольку уровни различных рядов в этом случае лежат на неодинаковой высоте, следует принять, что энергия валентного электрона в атоме щелочного металла зависит от величины момента импульса электрона (чего мы не наблюдали для водорода). Предположение о зависимости энергии валентного электрона щелочных атомов от квантового числа l подтверждается квантовомеханическими расчетами. В более сложных, чем водород, атомах можно считать, что каждый из электронов движется в усредненном поле ядра и остальных электронов. Это поле уже не будет кулоновским (т.е. пропорциональным 1/r2), но обладает центральной симметрией (зависит только от r). В самом деле, в зависимости от степени проникновения электрона в глубь атома заряд ядра будет для данного электрона в большей или меньшей степени экранироваться другими электронами, так что эффективный заряд, воздействующий на рассматриваемый электрон, не будет постоянным. Вместе с тем, поскольку электроны движутся в атоме с огромными скоростями, усредненное по времени поле можно считать центрально-симметричным.
Решение уравнения Шрёдингера для электрона, движущегося в центрально-симметричном некулоновском поле, дает результат, аналогичный результату для водородного атома, с тем отличием, что энергетические уровни зависят не только от квантового числа п, но и от квантового: числа l
E = Enl.
Таким образом, в этом случае снимается вырождение по l . Отличие в энергии между состояниями с различными l и одинаковыми п вообще не так велико, как между состояниями с различными п. С увеличением l энергия уровней с одинаковыми n возрастает.
Момент импульса атома в целом слагается из моментов всех электронов, входящих в состав атома. Значение результирующего момента определяется квантовым числом L. Каждому столбцу уровней на рис.1 соответствует свое значение L.
Использованные на схеме рис.1 обозначения s, p, d, f являются первыми буквами английских названий серий: sharp — резкий, principal — главный, diffuse — размытый, fundamental — основной. Каждая из серий возникает за счет переходов с уровней, принадлежащих соответствующему ряду. После того, как было выяснено, что различные ряды уровней отличаются значением квантового числа L, обозначения s, p, d, f были применены для обозначения состояний с соответствующими значениями L (или l).
Исследования оптических спектров ионов щелочных металлов показали, что момент импульса атомного остатка (т. е. ядра и остальных электронов, кроме наименее связанного валентного электрона, удаляющегося при ионизации) равен нулю. Следовательно, момент атома щелочного металла равен моменту его валентного электрона, и L атома совпадает с l этого электрона.
Для l валентного электрона атомов щелочных металлов действует такое же правило отбора, как и для l электрона водородного атома: Δl=±1.
При возбуждении атома щелочного металла и при испускании им света изменяется только состояние валентного электрона.
Поэтому схему уровней щелочного атома можно считать тождественной схеме уровней валентного электрона. Обозначим термы, отвечающие столбцам уровней, помеченным на рис.1 буквами s, p, d, f, символами ns, np, nd и nf.
Согласно формуле Бальмера частота спектральной линии равна разности термов конечного и начального состояний. Следовательно, спектральные серии натрия могут быть представлены в следующем виде:
резкая серия: = ЗР — nS (n = 4, 5, ...),
главная серия: = 3S — nР (n = 3, 4, ...),
диффузная серия: = ЗР — nD (n = 3, 4, ...),
основная серия: = 3D— nF (n = 4, 5, ...). (1)
Еще в конце прошлого столетия Ридберг установил, что термы щелочных металлов с большой степенью точности можно представить с помощью эмпирической формулы
![]() (2)
(2)
Здесь R — постоянная Ридберга, п — главное квантовое число, — дробное число, называемое ридберговской поправкой. Эта поправка имеет постоянное значение для данного ряда термов. Ее принято обозначать той же буквой, какой обозначен соответствующий ряд термов, — буквой s для S-термов, буквой р — для Р-термов и т. д. Значения поправок определяются экспериментально. Для разных щелочных металлов они имеют различные значения. Для натрия эти значения равны:
s = —1,35, р = — 0,87, d = —0,01, f = 0,00 (3)
Заметим, что терм (2) отличается от терма водородного атома только наличием поправки . Для F-термов эта поправка равна нулю. Поэтому основная серия (возникающая при переходах с F-уровней) оказывается водородоподобной.
Подставив эмпирические выражения в соотношения (1), получим следующие формулы для частот спектральных серий натрия:
резкая
серия:
![]() (n
= 4, 5, ...)
(n
= 4, 5, ...)
главная
серия:
![]() (n
= 3,4, 5, ...)
(n
= 3,4, 5, ...)
диффузная
серия:
![]() (n
= 3,4, 5, ...)
(n
= 3,4, 5, ...)
основная
серия:
![]() (n
= 4, 5, ...).
(n
= 4, 5, ...).
Поправки s, р, d, f в этих формулах имеют значения (3).
