
- •М инистерство образования российской федерации
- •Глава 1. Введение в электронную теорию твердого тела 5
- •Глава 2. Теория и практика эмиссионных процессов. 21
- •Глава 3. Электронно-вакуумные приборы с электростатическими полями 69
- •Глава 4. Теория и практика фокусировки и управления электронными пучками в электромагнитных полях 95
- •Глава 5. Электронно-лучевые приборы 133
- •Глава 6. Газоразрядная и плазменная электроника 158
- •Глава 1.
- •1.1.Энергия связи в твердом теле.
- •2.1. Металлическое состояние.
- •3.1. Состояние электрона в кристаллической решетке
- •4.1.Статистика электронов в кристаллической решетке металла.
- •5.1.Энергия Ферми.
- •6.1. Плотность электронных состояний.
- •7.1. Особенности зонной структуры ионных и ковалентных кристаллов.
- •8.1.Особенности положения уровня Ферми в полупроводниках.
- •Глава 2.
- •1.2. Работа выхода электрона из твердых тел.
- •2.2. Термоэлектронная эмиссия
- •1.3. Термоэлектронные катоды.
- •1.1.3. Металлические катоды.
- •2.1.3. Пленочные катоды
- •3.1.3. Оксидные катоды.
- •4.1.3. Способы нагрева катодов.
- •4.2. Закон Лэнгмюра-Богуславского.
- •4.2. Эффект Шоттки.
- •6.2. Автоэлектронная эмиссия.
- •6.2. Взрывная эмиссия.
- •8.2 Автоэмиссионные катоды.
- •7.2. Вторичная электронная эмиссия
- •8.2. Фотоэлектронная эмиссия.
- •10.2 Фотокатоды.
- •1.10.2. Фотокатоды для видимой области спектра.
- •2.10.2 Фотокатоды для ультрафиолетовой области.
- •3.10.2. Фотокатоды для инфракрасной области.
- •11.2 Аноды электронно-вакуумных приборов.
- •12.2 Управление электронным потоком
- •Глава 3.
- •1.3.Рентгеновские трубки.
- •Длина волны характеристических линий и потенциал возбуждения к-серии ряда элементов.
- •1.1.3 Области применения и конструктивные
- •2.1.3. Двухэлектродные трубки для просвечивания.
- •3.1.3. Импульсные рентгеновские трубки.
- •4.1.3. Трубки для диагностики биологических объектов.
- •5.1.3. Трубки для рентгенотерапии.
- •6.1.3. Рентгеновские трубки для радиационной химии
- •7.1.3. Рентгеноструктурный анализ.
- •8.1.3. Рентгеноспектральный анализ
- •9.1.3. Бескристальные спектрометры
- •2.3. Электронно-ионный микроскоп.
- •3.3. Фотоэлектронный умножитель.
- •Глава 4
- •1.4.Силы, действующие на заряженную частицу в электромагнитном поле. Уравнения движения.
- •2.4. Аналогия между движением заряженных частиц в электростатическом поле и распространением световых лучей в прозрачной среде.
- •3.4. Центрированные электронно-оптические системы.
- •4.4. Фокусировка электронных пучков в аксиально-симметричных
- •1.4.4. Катодная линза.
- •2.4.4. Электронные пушки.
- •3.4.4. Автоэмиссионные пушки.
- •4.4.4. Электронный прожектор.
- •5.4.4. Электростатические системы управления электронным лучом.
- •6.4.4. Анализатор скорости заряженных частиц.
- •7.4.4. Осциллографическая трубка.
- •5.4. Фокусировка и управление потоком заряженных частиц в постоянных магнитных полях.
- •1.5.4. Конструкции магнитных линз.
- •2.5. 4. Дефекты электронно-оптических линз.
- •3.5.4. Отклонение заряженных частиц магнитным полем.
- •Глава 5
- •1.5. Кинескопы.
- •2.5 Электронно-оптический преобразователь.
- •3.5. Электронные микроскопы.
- •1.3.5. Принцип работы электронных микроскопов.
- •2.3.5. Просвечивающие электронные микроскопы.
- •3.3.5. Рентгеновские микроанализаторы.
- •4.3.5. Растровые электронные микроскопы.
- •Глава 6.
- •1.6. Слабоионизированные газы.
- •2.6. Ионизация газа, находящегося в термодинамическом равновесии.
- •3.6. Диффузионный ток.
- •4.6. Проводимость
- •5.6. Ударная ионизация
- •6.6. Вольтамперная характеристики газового разряда.
- •1.6.6. Несамостоятельный газовый разряд.
- •2.6.6. Самостоятельный газовый разряд.
- •7.6. Газоразрядные приборы с холодным катодом
- •1.7.6. Дуговые разрядники.
- •2.7.6. Газоразрядные источники света.
- •3.7.6. Лампы тлеющего свечения (лтс).
- •4.7.6. Стабилитрон тлеющего разряда.
- •5.7.6. Многоэлектродные газоразрядные приборы тлеющего разряда.
- •6.7.6. Тиратрон тлеющего разряда.
- •7.7.6. Тиратроны дугового разряда.
- •8.6. Дисплеи с плазменной панелью.
- •1.8.6.Структура ячейки
6.1. Плотность электронных состояний.
Проведенные выше вычисления дают лишь значение ширины зоны; но не содержат в себе детального описания пространственного распределения энергетических уровней или их заселенности. Указанные характеристики можно определить исходя из следующих положений. Несмотря на то, что электронные состояния однородно распределены в пространстве импульсов (см. рис.4.1), они распределены неоднородно по шкале энергий. Заселенность данного интервала
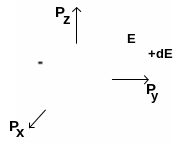

а б
Рис. 6.1. а). Число состояний в интервале от Е до E+dE равно числу состояний в сферическом слое толщиной dE. б). Зависимость плотности состояний от энергии.
энергетических
уровней именуется, плотностью состояний
N(E)
в интервале энергий от E
до E+dE
определяемой согласно равенствау
(14.1). Величину плотности состояний N(E)
можно интерпретировать, используя
изображение изоэнергетических
поверхностей в пространстве импульсов
(рис. 6.1,а). Внутренняя сфера представляет
собой поверхность постоянных значений
импульса и, следовательно, поверхность
с постоянной энергией. Внешняя сфера
также является сферой с постоянной
энергией E+dE.
Число электронов dN
с энергией, заключенной в пределах от
Е до E+dE,
выражается величиной N(E)dE,
или A(E-Eатом)![]() dE,
где A(E-Eатом)
представляет собой, в данном случае,
функцию плотности состояний. Вывод
формулы (14.1) не зависит от того, занято
данное состояние электроном либо нет,
так что она применима как для заполненной,
так и для незаполненной частей зоны.
Кривая, изображающая функцию
dE,
где A(E-Eатом)
представляет собой, в данном случае,
функцию плотности состояний. Вывод
формулы (14.1) не зависит от того, занято
данное состояние электроном либо нет,
так что она применима как для заполненной,
так и для незаполненной частей зоны.
Кривая, изображающая функцию
при значениях энергии, лежащих в пределах от дна до потолка зоны, представлена на рис. 6.1,б.
7.1. Особенности зонной структуры ионных и ковалентных кристаллов.
Большинство диэлектриков (изоляторов) относится к классу ионных кристаллов. К кристаллам этого класса не относится ни один чистый элемент; все они являются соединениями. Они могут иметь определенную химическую формулу, например NaCl, К(ОН) или MgO, и в этом смысле представляют собой единую фазу в двухкомпонентных (и многокомпонентных) фазовых диаграммах. С другой стороны, в них возможны вариации состава: например, существует целая серия ферритов, описываемая формулой [FeO(1-x)(NiO)x (Fe203)]. В этих случаях говорят, что ионные кристаллы могут отклоняться от стехиометрического состава так же, как и металлические твердые растворы. Однако для простоты рассмотрения мы обсудим лишь соединения из двух элементов строго определенного (стехиометрического) состава.
Ионные кристаллы - это главным образом неорганические соединения, и поэтому для них можно записать вполне определенную химическую формулу. Это, однако, не значит, что такое соединение может существовать и в виде отдельных молекул, как скажем, молекула NaCl. С другой стороны кристалл, например, каменной соли нельзя считать просто набором индивидуальных молекул NaCl. Правильнее считать весь кристалл гигантской молекулой, в которой данный ион испытывает значительное воздействие со стороны всех остальных ионов. Это становится вполне очевидным при рассмотрении энергии связи и зонной структуры ионных кристаллов показанной схематически на рис.7.1.
.
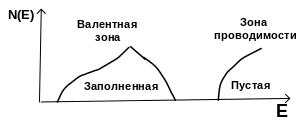
Рис. 7.1. Зависимость плотности состояний от энергии. Видно, что заполненная и незаполненная зоны отделены друг от друга областью запрещенных значений энергии. В ионном кристалле заполненная зона соответствует уровням, занятым валентными электронами отрицательного иона, а незаполненная зона незанятым уровням положительного иона. Заполненная зона кристалла называется валентной зоной, а незаполненная зоной проводимости.
Свойства ионных кристаллов тесно связаны с химической природой соответствующих соединений. Рассмотрим опять кристалл NaCl. Валентность натрия равна +1, т. е. атом натрия имеет один электрон, который он легко теряет, а именно Зs-электрон; с другой стороны, хлор имеет валентность -1, т. е. он легко принимает один электрон. Этот электрон занимает место в Зр-оболочке. Превращение 3s-электрона Na в 3p-электрон С1 происходит с изменением энергии, поскольку оба иона имеют только заполненные оболочки. После перехода ионы имеют результирующий электрический заряд: ион Na положительный, ион С1 отрицательный и они притягиваются друг к другу кулоновскими силами. По мере их сближения потенциальная энергия уменьшается. Полная энергия кристалла меньше, чем энергия газа, состоящего из нейтральных атомов Na и Cl.
Для связей в органических соединениях характерно наличие спаренных электронов. Например, в метане (СН4) четыре атома водорода соединены с атомом углерода связями спаренных (обобществленных) ls-электронов. таким путем в молекуле СН4 заполняется 2р-оболочка атома углерода Другим примером может служить аммиак NH3, в котором спаренные ls-электроны трех атомов водорода
обеспечивают заполнение 2р-оболочки атома азота N. Такие связи носят название ковалентных. Этот тип связи встречается также и в некоторых кристаллах, образующих важный класс твердых материалов. К этому классу относят и полупроводники, поскольку связи в них ковалентные.
Следует иметь в виду, что особые электрические свойства полупроводников дают основание выделить их, как это часто делается, в особую категорию. Однако поскольку основное различие между полупроводниками типа Ge и Si, с одной стороны, и диэлектриками типа алмаза с другой, состоит лишь в ширине запрещенной зоны, то свойства ковалентных полупроводников и ковалентных диэлектриков естественно обсуждать совместно.

Рис. 8.1. Схематический график зависимости плотности энергетических уровней от энергии в случае полупроводника.
Все ковалентные кристаллы по своей природе в основном изоляторы, а их зонная структура аналогична зонной структуре ионных кристаллов. При конденсации свободных атомов в твердое тело низколежащие энергетические уровни не изменяются, но самые наружные, расширяясь в полосы, образуют те, же зоны, что и у ионных кристаллов: заполненную и незаполненную (рис.7.1). На первый взгляд это кажется странным, так как все чистые моноатомные ковалентные кристаллы таких элементов, как, например, углерод (в виде алмаза), кремний и германий, имеют частично незаполненные атомные р-уровни. Однако s- и р-уровни распределяются так, что полный набор из восьми s+p - уровней расщепляется на две группы по четыре уровня в каждой, разделенные энергетической щелью, ширина которой является величиной, характерной для данного элемента (табл. 1.1).
Поскольку ковалентные кристаллы во внешней оболочке своих атомов имеют всего четыре s+p - электрона, то нижняя зона, называемая валентной, оказывается заполненной, а верхняя называемая зоной проводимости незаполненной (если не считать электронов, которые могут туда попасть в результате возбуждения).
Таблица 1.1.
Ширина запрещенной зоны ковалентных кристаллов (при 0°К) |
|
Кристалл |
Ширина эВ
|
С (алмаз) |
7,0 |
Ge |
0,75 |
Si |
1,21 |
Sn(серое олово) |
0,08 |
GaAs |
1,45 |
GaSb |
0,8. |
InAs |
0,5 |
Легко понять механизм действия примесей на электронную конфигурацию. Если в атомах, добавляемых в качестве примеси, число s+p - электронов меньше четырех (например, при введении галлия в германий), то в запрещенной зоне вблизи верхнего края валентной зоны появляются дополнительные уровни (рис.8.1). Если же у добавляемых в качестве примеси атомах число s+p - электронов больше четырех (например, при введении в германий мышьяка), то дополнительные уровни в запрещенной зоне появляются вблизи дна зоны проводимости. Такие примеси оказывают в высшей степени сильное влияние на проводимость и оптические свойства.
Ширина запрещенной зоны в разных кристаллах изменяется от величины, близкой к нулю (для серого олова), до, примерно, 7 эВ (для алмаза). Значения ширины запрещенной зоны для некоторых наиболее важных ковалентных кристаллов приведены в табл.1.1.
Заметим, что последние три соединения относятся к числу веществ, которые в среднем имеют четыре электрона на атом, а каждый из элементов, составляющих соединение, сам по себе в твердом состоянии не может образовать ковалентного кристалла со структурой алмаза.
Ковалентные связи относятся к числу сильных связей, поэтому ковалентные кристаллы имеют большую энергию связи. Типичными являются величины порядка 3-5 эВ на 1 атом. Поскольку волновые функции этих кристаллов невозможно описать сколько-нибудь просто, мы не будем пытаться обосновать приведенные числовые значения.
