
- •Хімічний зв’язок і взаємний вплив атомів в органічних молекулах
- •1.1 Природа хімічного зв’язку
- •Ковалентний зв΄язок – це зв΄язок, що утворюється між атомами внаслідок успільнення їх зовнішніх валентних електронів (з обов΄язковим зменшенням енергії молекули).
- •1.2 Типи ковалентних зв’язків
- •Гібридизація атомних орбіталей
- •Прості й кратні ковалентні зв’язки
- •Основні характеристики ковалентного зв’язку
- •2.1 Взаємний вплив атомів в молекулах Будова та реакційна здатність органічних сполук
- •2.1.1 Індуктивний ефект Це зміщення електронної густини в -зв’язках, що виникає внаслідок різниці електронегативностей атомів.
- •2.1.2 Кон’юґовані системи та мезомерний ефект
- •Ефект гіперкон΄юґації або надспряження.
2.1 Взаємний вплив атомів в молекулах Будова та реакційна здатність органічних сполук
Що таке реакційна здатність? Реакційна здатність – це швидкість, з якою сполука реагує з певним реагентом, причому сполука може мати малу реакційну здатність відносно, наприклад, кисню, але бути дуже реакційно здатною відносно води. На реакційну здатність впливають електронні ефекти функційної групи, її оточення, стеричні та електронні властивості інших груп молекули та ефекти міжмолекулярних взаємодій.
Здатність замісників передавати свій вплив уздовж ланцюга ковалентно сполучених атомів є найхарактернішою властивістю органічних сполук.
Під впливом замісників можливі два типи електронних зміщень: зміщення -електронів та зміщення -електронів. Схематично це позначають формулами з частковими зарядами та прямими або зігнутими стрілками.

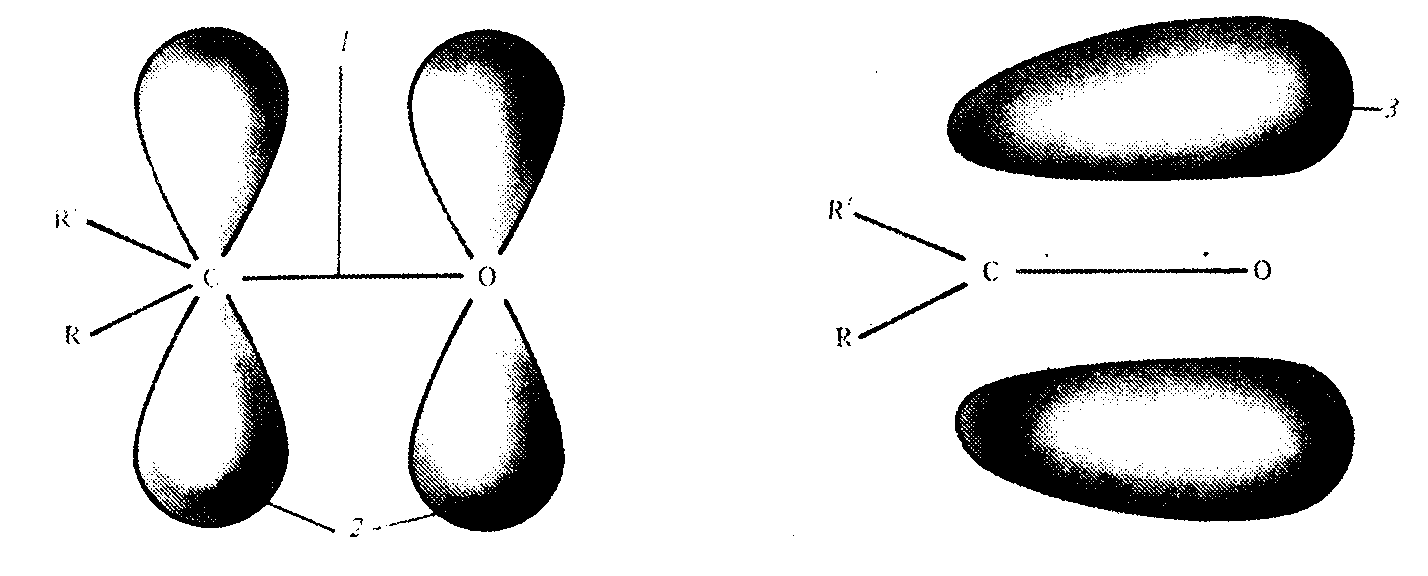
2.1.1 Індуктивний ефект Це зміщення електронної густини в -зв’язках, що виникає внаслідок різниці електронегативностей атомів.
Його позначають буквою І і показують прямою стрілкою на σ-зв΄язку. Він може бути негативним або позитивним, залежно від електроноакцепторних або електронодонорних властивостей атомів і позначається знаком + або . Наприклад, молекула бутану неполярна, бо електронегативність С-атомів і Н-атомів майже однакова, усі вуглецеві атоми знаходяться в стані sp3-гібридизації, тобто також не відрізняються за електронегативністю. При введенні до складу молекули атома з більшою електронегативністю відбувається зміщення електронної густини зв’язку ССl в бік хлору та утворення на вуглецевому атомі часткового позитивного заряду.
H3C-CH2-CH2-CH3 H3C-CH2-CH2-CH2 Cl
Щоб компенсувати цей частковий позитивний заряд, вуглецевий атом “відтягує” електронну густину від сусіднього С-атому, а той, в свою чергу, від іншого, і так далі. У наведеному прикладі атом хлору виявляє негативний індуктивний ефект –І, а алкільний радикал – позитивний +І. Взагалі, прийнято вважати, що атоми й групи атомів, що виявляють електронодонорні властивості, виявляють позитивний індуктивний ефект (+І), а ті що виявляють електроноакцепторні властивості – негативний (І0. За стандарт прийнято атом водню І=0, хоч насправді зв΄язок СН слабополярний і має дипольний момент =0,3D.
RCH2+A- RCH2H RCH2-B+
-I I=0 +I
Позитивний індуктивний ефект виявляють лужні метали, бор, групи атомів з повним негативним зарядом та алкільні радикали. Алкільні групи виявляють слабкі електронодонорні властивості і сила їх зменшується в ряду:
третинний > вторинний > первинний (СН3)3С (СН3)2СН СН3СН2 СН3 Н
Негативний – позитивно заряджені атоми й групи атомів, атоми з більшою електронегативністю ніж вуглець, залишки ненасичених та ароматичних вуглеводнів: вініл –СН=СН2, етеніл -ССН, феніл –С6Н5, наприклад:СН3СН=СН2
Г оловну
роль в силі індуктивного ефекту відіграє
заряд центрального атому замісника.
Великий негативний індуктивний ефект
виявляють діазогрупа (N+N),
триметиламонійна група (N+Me3)
нітрогрупа ( ), трихлорметильна
група (СCl3)
оловну
роль в силі індуктивного ефекту відіграє
заряд центрального атому замісника.
Великий негативний індуктивний ефект
виявляють діазогрупа (N+N),
триметиламонійна група (N+Me3)
нітрогрупа ( ), трихлорметильна
група (СCl3)
Через те, що в періодичній таблиці елементів електронегативність зростає зліва направо і знизу догори, замісники за силою І-ефекту можна розташувати у відповідні ряди:
F Cl Br І; F OR NR2 ;
Класичним проявом індуктивного ефекту є вплив замісника на силу карбонової кислоти:
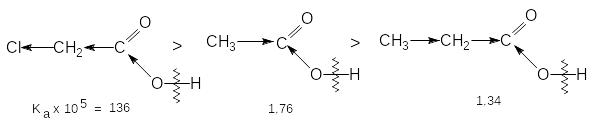
Індуктивний ефект може впливати на хід хімічної реакції. Наприклад при бромуванні карбонових кислот заміщуються тільки -водневі атоми. Ця підвищена рухливість -водневих атомів пояснюється негативним індуктивним ефектом карбоксильної групи:

