
- •Гідроксивуглеводні
- •7.1 Класифікація гідроксивуглеводнів:
- •Будова та реакційна здатність
- •Хімічні властивості
- •Реакції нуклеофільного заміщення гідроксильної групи sn
- •2. Реакція естерифікації.
- •3. Заміщення гідроксилу на аміногрупу:
- •3Дегідратація спиртів При нагріванні спиртів в присутності концентрованої сірчаної кислоти або безводної фосфорної відбувається вилучення води від спиртів, тобто їх дегідратація.
- •7.3.3 Методи добування спиртів
- •Методи добування фенолів
Гідроксивуглеводні
Це вуглеводні, що містять у своєму складі одну або кілька гідроксильних груп. Гідроксильна група визначає хімічні властивості двох важливих класів органічних сполук – спиртів і фенолів, які ми розглядатимемо.
7.1 Класифікація гідроксивуглеводнів:
1. Залежно від кількості гідроксильних груп - одноатомні, двохатомні...
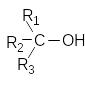
Залежно від атома вуглецю, з яким сполучена гідроксильна група
а) первинні R-СН2OH
б)
вторинні

в) третинні
Залежно від типу гібридизації вуглецевого атома, з яким сполучена гідроксильна група
sp3
- гібридизація
![]() - спирти
- спирти
sp2
- гібридизація:
 -еноли
-еноли
нестабільні
 - феноли
- феноли
Будова та реакційна здатність
Хімічні властивості зумовлені взаємним впливом гідроксильної групи та вуглеводневого радикалу.
Спирти мають чотири реакційні центри: полярний зв’язок О-Н; мало полярний зв’язок С-О; зв’язки С-Н в алкільних групах і неподілені електронні пари на атомі кисню.
Вплив функційної групи спиртів на радикал пояснюється негативним індукційним ефектом (-І) гідроксильної групи:

алкокси-йон -I карбеній- гідрокси-
йон йон
Як можна побачити на схемі, обидва зв’язки О-атома поляризуються й стають здатними до гетеролітичного розриву. На вуглецевому та водневому атомах утворюється частковий позитивний заряд. Внаслідок цього спиртам властиві реакції нуклеофільного заміщення гідроксилу. Але чим більшим є позитивний заряд на вуглецевому атомі, тим більш поляризованим є О-Н-зв’язок і тим легше відбувається відрив протону.
У молекулах фенолів (енолів) вплив функціональної групи здійснюється також через позитивний мезомерний ефект (+М) гідроксилу або р- - спряження.

енолят-аніон
При цьому зв’язок СО скорочується, зменшується його полярність і здатність до реакцій нуклеофільного заміщення.
У молекулі фенолу електронна густина на атомі кисню також зменшується внаслідок +М-ефекту. Через це кисень значно сильніше відтягує до себе електронну густину від водневого атома, ніж у випадку аліфатичних спиртів. Поляризація НО-зв’язку в молекулах фенолів збільшується й водневий атом фенольного гідроксилу набуває рухливості, що зумовлює значне збільшення кислотних властивостей фенолів порівняно із спиртами. Крім цього фенолят-аніон більш стабілізований унаслідок делокалізації негативного заряду в ароматичному ядрі.
Хімічні властивості
Спирти здатні відщеплювати протон від гідроксильної групи й таким чином виявляти кислотні властивості. Але вони також здатні приєднувати протон до неподіленої електронної пари О-атома й виявляти тим самим основні властивості, тобто спирти мають амфотерні властивості - здатність виявляти кислотні та основні властивості водночас.
А. Кислотні властивості:

Кислотні та основні властивості спиртів досить слабкі. Стала іонізації для СН3ОН дорівнює 1.10-17, для Н2О - 1,8.10-16, тобто спирти більш слабкі кислоти, ніж вода.
Спирти реагують з лужними металами з утворенням солей - алкоголятів:
2 R-OH + 2 Na 2 R-ONa + H2
З лугами спирти не взаємодіють
Алкоголяти легко розкладаються водою:
![]()
Із збільшенням кількості вуглецевих атомів в алкільному радикалі кислотні властивості спиртів зменшуються через те, що алкільний радикал, що виявляє позитивний індуктивний ефект, збільшує електронну густину на атомі кисню гідроксильної групи, а це спричиняє зменшення стійкості аніонів RCH2О. За здатністю відщеплювати протон спирти можна розташувати в ряд:
Вода метанол > первинний спирт вторинний спирт третинний спирт
 Кислотні
властивості гліколей більші за кислотні
властивості одноатомних спиртів через
те, що внаслідок негативного індукційного
ефекту (I)
одна гідроксильна група відтягує від
іншої електронну густину, тому й гліколі
взаємодіють не тільки з лужними металами,
але й з лугами. До того ж будова 1,2-гліколів
сприяє утворенню комплексних сполук з
гідроксидами важких металів:
Кислотні
властивості гліколей більші за кислотні
властивості одноатомних спиртів через
те, що внаслідок негативного індукційного
ефекту (I)
одна гідроксильна група відтягує від
іншої електронну густину, тому й гліколі
взаємодіють не тільки з лужними металами,
але й з лугами. До того ж будова 1,2-гліколів
сприяє утворенню комплексних сполук з
гідроксидами важких металів:
А кислотні властивості гліцерину виражені ще сильніше, ніж в одно- та двохатомних спиртів. Ступінь дисоціації гліцерину ~ в 10 раз більший, ніж метилового спирту. Тому гліцерин також легко утворює гліцерати (алкоголяти) як з лужними металами, так і з лугами та гідроксидами заліза, міді, кальцію, барію та ін. Нерозчинний у воді гідроксид міді розчиняється з утворенням комплексної сполуки яскраво-синього кольору. Ця реакція є якісною на багатоатомні спирти, у яких гідроксильні групи знаходяться біля сусідніх атомів вуглецю. Одноатомні спирти з Сu(OH)2 не взаємодіють.

Кислотні властивості фенолів.. Унаслідок кон’юґації неподіленої електронної пари кисню з -електронами бензенового ядра (+М-ефект) електронна густина на О-атомі фенолу зменшується, збільшується полярність Н-О зв’язку в молекулах фенолу й рухливість Н-атому гідроксильної групи.
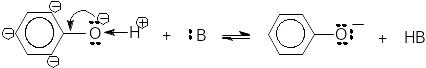
Отже кислотні властивості фенолів збільшуються й виявляються значно сильніше, ніж у спиртів.
Утворення фенолятів у водних розчинах лугів.
![]()
(Спирти здатні утворювати алкоголяти тільки з лужними металами)
На кислотні властивості фенолів впливає введення замісників до бензенового ядра та їх розташування відносно ОН-групи. Електронодонорні замісники (орієнтанти I роду) послаблюють кислотні властивості, а електроноакцепторні замісники (орієнтанти II роду) і атоми галогенів, зменшуючи електронну густину ароматичного ядра, водночас зменшують її на атомі кисню ОН-груп і підсилюють кислотні властивості фенолів. Наприклад, введення нітрогрупи в орто- й пара-положення значно підвищує кислотні властивості фенолів, а нітрогрупа в мета-положенні не спряжена з фенольним гідроксилом і мало впливає на кислотні властивості фенолів:

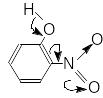
Б. Основні властивості спиртів
Унаслідок наявності неподіленої електронної пари на кисневому атомі гідроксильної групи спирти здатні виявляти слабкі основні властивості. При дії сильних кислот вони перетворюються на більш-менш стабільні алкілоксонієві сполуки:

Основні властивості найбільше виражені у третинних спиртів, найменше - у метилового спирту.
