
- •Практикум по физической химии
- •Часть 1
- •Химическая термодинамика
- •1. Кондуктометрия
- •1.1. Основные понятия, особенности методики, используемое оборудование
- •1.1.1 Основные понятия и законы кондуктометрии
- •Теория Дебая – Хюккеля и электропроводность растворов (подробнее о теории Дебая – Хюккеля см. Раздел 2.1.8)
- •1.1.2. Измерение электропроводности растворов электролитов
- •1.1.3. Приборы и оборудование для измерения электропроводности
- •1.2. Лабораторные работы
- •1.2.1. Работа к-1. Кондуктометрическое титрование
- •Обработка результатов
- •1.2.2. Работа к-2. Определение константы диссоциации уксусной кислоты
- •1.3. Контрольные вопросы к работам к-1 и к-2
Теория Дебая – Хюккеля и электропроводность растворов (подробнее о теории Дебая – Хюккеля см. Раздел 2.1.8)
Теория Дебая – Хюккеля позволяет рассчитывать коэффициенты активности ионов. Для наглядности представим себе большой многозарядный ион, например, положительно заряженную коллоидную частицу, которая помещается в раствор электролита. Вблизи этой частицы происходит перераспределение ионов, возникает избыток анионов и недостаток катионов в сравнении со средней по раствору концентрацией. Если зафиксировать это распределение, или ионную атмосферу, и убрать из раствора коллоидную частицу, то в месте, где она располагалась, обнаружится потенциал, создаваемый ионной атмосферой. Ясно, что если вернуть частицу обратно в раствор, то её энергия будет зависеть от потенциала ионной атмосферы в точке, где она находится. Задача теории состоит в определении коэффициента активности заряженной частицы, зависящего от энергии её взаимодействия с ионной атмосферой. Выводы теории оказываются справедливыми и для частиц небольшого размера, включая однозарядные ионы. Важным параметром теории является радиус ионной атмосферы ra, который рассчитывается по формуле
![]()
![]()
где для воды при 25 oС
![]()
Например, при ионной силе раствора 10–2 М, радиус ионной атмосферы 3 нм.
Итак, каждый ион в растворе окружён симметричной ионной атмосферой, образованной ионами противоположного знака. Наличие ионной атмосферы ведёт к снижению скорости движения иона. Действуя на ион, поле одновременно действует и на его атмосферу, заставляя её сдвигаться в противоположном направлении. В результате возникает тормозящий эффект, который получил название электрофоретического. Кроме того, при движении иона нарушается сферическая симметрия его ионной атмосферы и появляется сила кулоновского взаимодействия, направленная противоположно внешнему полю. Этот эффект тем больше, чем больше скорость иона, и приводит к дополнительному торможению, пропорциональному скорости. Второй эффект называется релаксационным.
Применение теории Дебая – Хюккеля к задаче измерения электропроводности растворов электролитов приводит к формуле (1.6). Проверим размерность величины В, а также коэффициентов b1 и b2:
![]()
или, если ионная сила измеряется в моль / л, для размерности В имеем
![]()
Учтено, что
![]()
![]()
Размерность величины (b1 I1/2) совпадает с размерностью эквивалентной электропроводности :
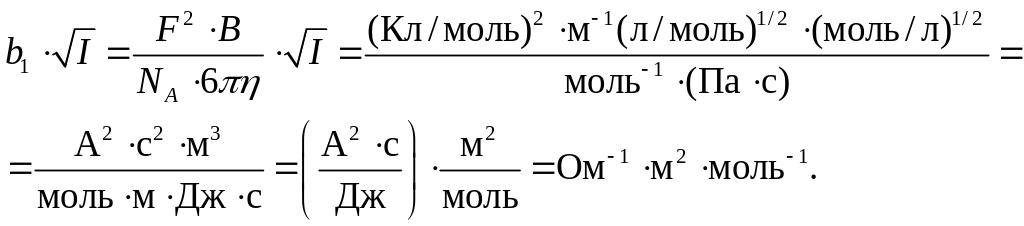
Произведение b2I1/2 является безразмерной величиной.
![]()
Поэтому размерность b1 есть
![]()
а размерность b2:
![]()
1.1.2. Измерение электропроводности растворов электролитов
Ионы в растворе находятся в состоянии хаотического движения. При приложении внешнего постоянного электрического поля возникает электрический ток, т. е. появляется дрейф ионов в определённом направлении. Скорость дрейфа в поле с единичной напряжённостью – это подвижность иона, которая однозначно связана с его ионной электропроводностью. Поэтому для вычисления электропроводности раствора, в принципе, достаточно знать протекающий ток и измерить напряжённость поля внутри раствора. Сложность состоит в том, что электрическое поле в измерительной ячейке существенным образом неоднородно.
Электрический ток в ячейке течёт не только в промежутке между электродами, но растекается во всём доступном пространстве. Поскольку напряжённость поля вдоль «линий тока» обратно пропорциональна их длине, то, как видно из рис. 1.1, поле в ячейке приблизительно однородно только в небольшой области напротив центров электродов, где «линии тока» параллельны и имеют одинаковую длину. Таким образом, сопротивление кондуктометрической ячейки зависит не только от расстояния между электродами и их площади, но и от формы сосуда, уровня залитого электролита, т. е. от «геометрии» ячейки.

Рис. 1.1. Направление распространения тока в двухэлектродной кондуктометрической ячейке
Другой причиной неоднородности поля является поляризация электродов, или скачок потенциала вблизи электродов, связанный с изменением типа проводимости при переходе от жидкого раствора (ионная проводимость) к металлическим электродам (электронная проводимость). Подходя к электроду, ион должен разрядиться, иначе цепь постоянного тока не будет замкнута. Однако разряд иона – медленный процесс, требующий определённой энергии активации. В результате оказывается, что закон Ома при измерении сопротивления раствора электролита на постоянном токе не выполняется. Если ионы не успевают разряжаться, они накапливаются возле электродов, создавая двойной электрический слой (рис. 1.2), что приводит к снижению эффективного потенциала электрода и напряжённости поля в объёме электролита.

Рис. 1.2. Образование двойного электрического слоя около электродов
Применение переменного тока для измерения электропроводности растворов электролитов резко снижает эффекты, связанные с поляризацией электродов. Кроме того, существенно уменьшается или совсем прекращается электролиз исследуемого раствора. В ячейке постоянного тока происходит однонаправленный дрейф ионов к катоду или аноду. При переходе от постоянного тока к переменному направление дрейфа ионов меняется с частотой равной частоте переменного тока. Двойной электрический слой вблизи электродов при достаточно большой частоте переменного тока не успевает формироваться. В принципе электроды могут даже располагаться вне измерительной ячейки и не иметь гальванического контакта с жидким раствором. Таким образом, использование переменного тока и некоторые другие приемы (увеличение площади электродов, уменьшение силы тока и пр.) позволяют устранить нежелательные эффекты поляризации электродов.
Сопротивление раствора зависит от его удельной электропроводности и геометрической формы сосуда, в котором проводятся
измерения. Для сосуда любой произвольной формы можно записать:
![]()
Произведение
R![]() =
не зависит от конкретного электролита
и называется постоянной
ячейки,
определяемой только её геометрией. Для
определения постоянной ячейки применяют
простой приём. В выбранной ячейке
предварительно измеряют сопротивление
Rст
стандартных растворов с известной
удельной электропроводностью ст.
В качестве таковых используют 0,1 N
и 0,01 N
водные растворы хлористого калия,
взятые при 25 oС,
для которых
=
не зависит от конкретного электролита
и называется постоянной
ячейки,
определяемой только её геометрией. Для
определения постоянной ячейки применяют
простой приём. В выбранной ячейке
предварительно измеряют сопротивление
Rст
стандартных растворов с известной
удельной электропроводностью ст.
В качестве таковых используют 0,1 N
и 0,01 N
водные растворы хлористого калия,
взятые при 25 oС,
для которых
![]() = 0,01289
Смсм–1,
= 0,01289
Смсм–1,
![]() = 0,001411 Смсм–1.
Произведение Rстст
даёт значение .
Постоянная ячейки является пересчётным
коэффициентом для перевода измеренного
значения сопротивления в удельную
электропроводность электролита. Если
она известна, то удельная электропроводность
раствора электролита может быть
определена по его сопротивлению как
= 0,001411 Смсм–1.
Произведение Rстст
даёт значение .
Постоянная ячейки является пересчётным
коэффициентом для перевода измеренного
значения сопротивления в удельную
электропроводность электролита. Если
она известна, то удельная электропроводность
раствора электролита может быть
определена по его сопротивлению как
![]()
Для промышленно выпускаемых кондуктометров постоянная ячейки (или датчика) обычно измеряется в заводских условиях. Конструкции используемых в практикуме кондуктометров и кондуктометрических ячеек описаны ниже.
