Министерство образования Российской Федерации
Государственное образовательное учреждение
высшего профессионального образования
«Алтайский государственный технический университет
им. И.И. Ползунова»
Бийский технологический институт (филиал)
Н. В. Степанова, А. Л. Верещагин
Комплексонометрия
Методические рекомендации к лабораторным работам по курсу
«Аналитическая химия» для студентов специальностей
251200, 251100, 270500, 070100 И 351100 всех форм обучения
Барнаул 2004
1 Теоретическая часть
1. 1 Основные положения
Комплексонометрические определения входят в группу методов титриметрического анализа, в основе которых лежат реакции комплексообразования. Эта группа методов объединяется под общим названием комплексонометрия. Особенностью комплексонометрии является то, что в качестве основных титрантов в ней используются специфические вещества – комплексоны, образующие с определяемыми реагентами (катионами металлов) так называемые хелатные (внутрикомплексные) соединения.
Если исходить из основных требований к реакциям, используемым в объемном анализе: стехиометричность (вещества реагируют в строго стехиометричных количествах), количественное протекание (отсутствие побочных процессов), достаточно большая скорость, наличие способа определения эквивалентной точки, то лишь немногие комплексы удовлетворяют этим требованиям. При образовании простых комплексов реакции идут ступенчато, то есть по ступеням протекает замена молекул воды гидратной оболочки катионов металла, находящихся в водном растворе, другими лигандами. Из-за одновременного протекания процесса по различным ступеням образуется ряд комплексов различного состава, находящихся в растворе одновременно. Следовательно, вещества реагируют не в стехиометрических отношениях.
Успеха в применении органических реактивов в объемном анализе достигли тогда, когда были предложены многолигандовые реагенты. В 1945 г. быди предложены новые органические реагенты - полиаминокислоты, получившие название “комплексоны”. Комплексоны образуют прочные, растворимые в воде внутрикомплексные соединения с катионами различных металлов.
1. 2 Комплексоны
Комплексоны - это аминополикарбоновые кислоты и их соли, представляющие собой полидентатные лиганды.
Группу атомов (молекулу или ион), которая может связываться с одним и тем же ионом металла несколькими из своих атомов, называют хелатообразующей или полидентатным лигандом. Известны хелатообразующие агенты, координирующиеся двумя, тремя, четырьмя,пятью, шестью или даже восемью донорными атомами; чаще встречаются агенты с двумя донорными атомами. Такие полидентатные лиганды называют соответственно би-, три-, тетра-, пента- и гексадентатными.
Первыми комплексонами, нашедшими применение в объёмном методе анализа были:
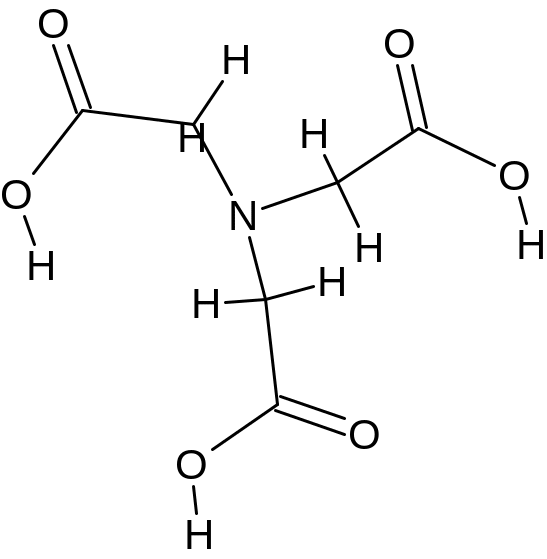
Комплексон I – нитрилотриуксусная кислота (НТА, условно (X3Y):
|
(дентат. = 4); |
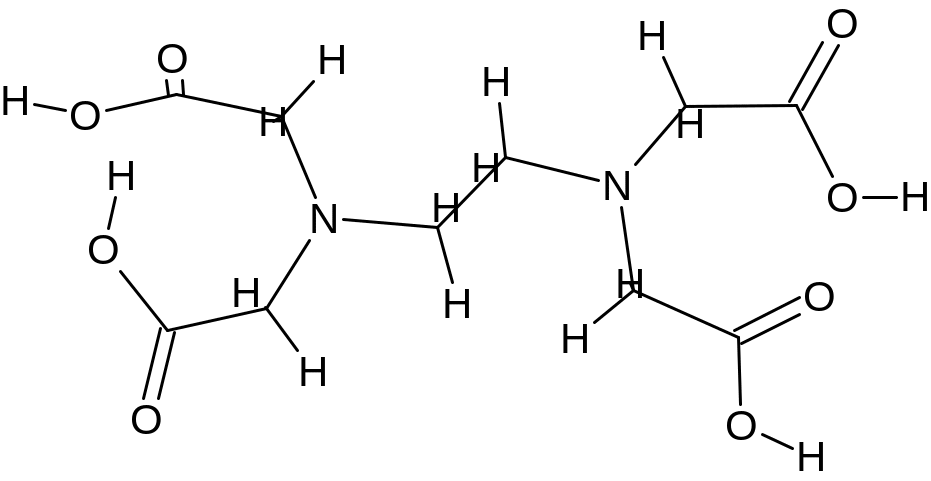
комплексон II - этилендиаминтетрауксусная кислота (ЭДТА, условно XH4Y):
|
(дентат. =6); |
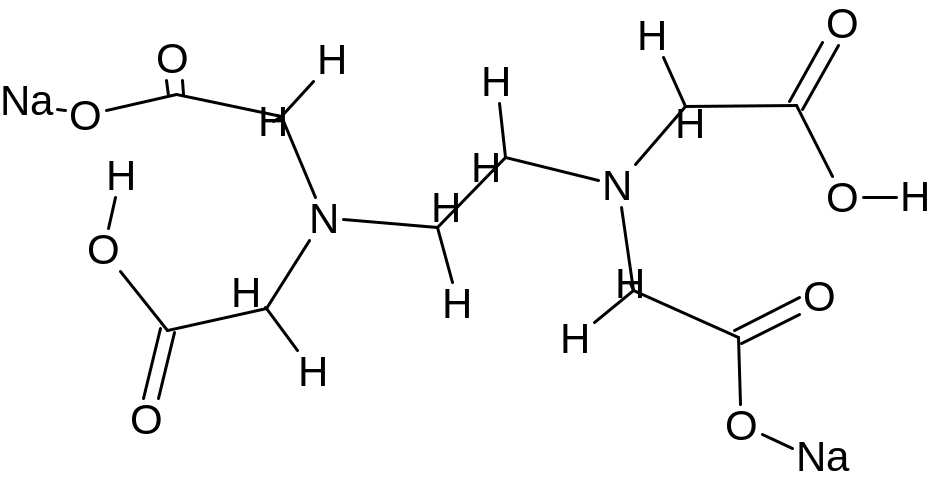
Комплексон III - дигидрат двунатриевой соли этилендиаминтетрауксусной кислоты (условно Na2H2Y):
|
(дентат. =6). |
Комплексоны вступают в реакции с катионами многих металлов в отношении 1:1, образуя малодиссоциирующие растворимые в воде комплексы, соли, называемые комплексонатами.
Катионы Mg2+, Ca2+, Sr2+, Ba2+, Al3+, Mn2+, Cd2+, Zn2+, Fe2+, Co2+, Ni2+, Cu2+ образуют с комплексонами в кислой и нейтральной средах содинения состава H[Me2+X3-] или [Me2+X3-].
Схематически взаимодействие двух-, трех- и четырехзарядных катионов с трилоном Б выражается следующими уравнениями:
Me2+ + Na2H2Y Na2MeY + 2H+;
Me3+ + Na2H2Y NaMeY + 2H+ + Na+;
Me3+ + Na2H2Y MeY + 2H+ + 2Na+.
Например, катионы кальция связываются с комплексоном III по уравнению:
Ca2+ + Na2H2Y Na2[ CaY ] + 2H+.
Комплексные соли комплексона III (трилона Б) с металлами называют соответственно трилонатами. Внутрикомплексные ионы, образуемые трилоном Б с ионами Me2+, имеют следующее строение:
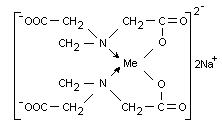
Трилон Б образует прочные растворимые в воде комплексные соединения с большим числом катионов металлов путем замещения атомов водорода карбоксильных групп на металл и координации последнего с азотом.
Прочность трилонатов очень велика.Так, например, константа устойчивости трилоната никеля равна NiY2-= 4,2. 1018. На устойчивость этих внутрикомплексных ионов мало влияют температура и органические растворители. При всех значениях pH катионы металлов любой степени окисления реагируют в отношении 1:1. На основании величин констант нестойкости комплексов сделаны выводы, что у двухзарядных катионов трилонаты устойчивы в щелочных и аммиачных растворах, а у трехзарядных - даже в кислых растворах. С увеличением степени окисления металла прочность комплексонатов (трилонатов) возрастает.
1. 3 Индикаторы, применяемые в комплексонометрии
В комплексонометрии чаще всего для фиксирования момента эквивалентности применяют индикаторы, меняющие свой цвет в зависимости от концентрации ионов металла в растворе, а поэтому называющиеся металлоиндикаторами. Они являются органическими красителями и в свободном состоянии окрашены. С катионами металлов они образуют внутрикомплексные интенсивно окрашенные соединения (отличающиеся по цвету от окраски индикатора в свободном состоянии).
HInd2- + Me2+ MeInd- + H+ (1)
синий красный
Если к раствору такого соединения добавить титрованный раствор комплексона III (трилона Б), то внутрикомплексное соединение металла с индикатором разрушается и образуется новое внутрикомплексное соединение, более прочное (трилонат). Освободившиеся молекулы (ионы) индикатора изменяют окраску раствора:
MeInd- + HI3- MeI2- + HInd- . (2)
красный синий
Таким образом, в точке эквивалентности наблюдается переход от окраски раствора комплекса металла с индикатором (например, красной) к окраске самого индикатора. Если металл связан прочнее с индикатором, чем с комплексоном (т.е. устойчивость комплексоната
меньше), то титрование невозможно (индикатор «блокирован»). Так как индикаторы изменяют окраску также и с изменением значений pH раствора, то титровать необходимо в буферных растворах.
Важнейшие индикаторы - эриохром черный Т и мурексид.
Эриохром черный Т (хромоген черный специальный ЕТ-00) - азокраситель, 0,0-диоксиазосоединение C20H13O7Na3S (условноH3Ind):
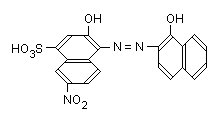
Индикатор диссоциирует с образованием Н+, Н2Ind-, HInd2-, Ind3-, поэтому эриохром чёрный Тспособен реагировать с ионами металла-комплексообразователя с образованием комплексных соединений. Сам индикатор окрашен в синий цвет. В нейтральной или щелочной среде при рН= 7...10 он образует с ионами металлов соединения красного цвета.
Чтобы окраска комплекса резко отличалась от окраски самого индикатора, титрование суказанным индикатором ведут при pH=9,3 (в присутствии аммиачного буфера) с образованием комплексных соединений красного цвета.
Мурексид (аммонийная соль пурпурной кислоты):
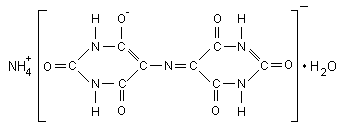
Мурексид представляет собой тёмно-красный порошок. Водный раствор мурексида окрашен в фиолетово-красный цвет, изменяющийся в зависимости от среды: при рН 9 – красно-фиолетовый, рН =9...10 –фиолетовый, рН 11 синефиолетовый. С катионами металлов мурексид образует комплексные растворимые в воде соединения красного или жёлтого цвета. Комплексы металлов с мурексидом имеют значительную устойчивость. Их прочность повышается с увеличением pH. Наиболее устойчивы комплексы с медью. С Ca2+ мурексид образует красный комплекс, с ионами Cu2+, Ni2+, Co2+ образует желтый комплекс.
При определении содержания ионов Ca2+ следует создавать значение pH > 12, так как при этом резче происходит переход окраски от красной к сине-фиолетовой. При определении содержания ионов Cu2+, Co2+ создают pH = 9 (аммонийным буфером), при этом происходит переход окраски от желтой к красно-фиолетовой.
Кроме того, применяют как индикаторы кислотный хром синий, кислотный темно-синий, сульфосалициловую кислоту и др.
1. 4 Комплексонометрическое титрование
В настоящее время комплексоны (и особенно трилон Б - ЭДТА) применяют в самых различных методах анализа - колориметрии, потенциометрии, гравиметрии и др. В титриметрическом анализе комплексоны применяют для определения общей жесткости воды, для анализа различных фармацевтических препаратов и т. д. Такое широкое распространение комплексонов, особенно, трилона Б связано прежде всего с тем, что из одной пробы анализируемого раствора можно определять до пяти катионов при различных значениях pH раствора, а также с большой точностью метода.
Приемы комплексонометрического титрования могут быть различными: прямое титрование, обратное, титрование по методу вытеснения и алкалиметрическое.
1.4.1 Прямое титрование
В бюретку наливают титрованный раствор трилона Б, в колбу для титрования - раствор, содержащий ион металла. Этот раствор перед титрованием доводят до определенного значения pH 9...10 (добавлением буфера, например, аммонийного). Титрование проводят в присутствии металлоиндикатора, реагирующего на изменение показателя концентрации иона металла в растворе (точнее, на изменение показателя концентрации иона металла pMe аналогично тому, как pH-индикатор реагирует на изменение pH). Раствором трилона Б титруют до тех пор, пока все катионы металла из комплекса с металлоиндикатором не перейдут в комплексонат, что со-провождается изменением окраски раствора в конечной точке.
Этим методом определяют ионы многих металлов, например, кальция, бария, стронция, никеля и др.
1.4.2 Обратное титрование
В том случае, когда надежный индикатор на ион металла отсутствует или pH, необходимый для образования комплекса вызывает осаждение определяемого металла, применяют метод обратного титрования. Титрованный раствор трилона Б добавляют в заведомом избытке к раствору анализируемой соли. Устанавливают, вводя буферный раствор, нужное значение pH. Избыток трилона Б оттитровывают раствором хлорида магния или хлорида цинка. Точка эквивалентности фиксируется по изменению окраски индикатора (например, эриохрома черного Т). Обратное титрование применяют также, когда ионы металла взаимодействуют с титрантом или металл-индикатором медленно.
1.4.3 Титрование путем вытеснения
Этот метод применяют в тех случаях, когда:
1) определяют содержание металла, входящего в состав труднорастворимого осадка (например, MgNH4PO4);
2) нет подходящего индикатора для прямого титрования в случае блокировки индикатора (то есть индикатор связан с металлом в более прочный комплекс, чем комплекс металла с трилоном);
3) реакция идет очень медленно.
В этом случае можно соединение с комплексоном получить обменной реакцией при титровании соли определяемого металла с ЭДТА (например, раствором комплексоната магния Na2[ MgY ] или цинка Na2[ZnY]). К анализируемому раствору прибавляют комплексонат магния (его получают титрованием или используют готовый), реакция идет по уравнению:
Me2+ + Na2[ MgY ] Na2[ MeI ] + Mg2+ . (3)
Mg2+ вытесняется в количестве, эквивалентном количеству ионов металла, связанных в прочный комплекс с ЭДТА. Вытесненный Mg2+ титруют трилоном Б.
Для применения этого метода необходимо, чтобы образующееся соединение определяемого металла с комплексоном было более прочным, чем комплексонат магния или цинка.
1.4.4 Алкалиметрическое титрование (титрование щёлочью)
Это титрование, основанное на изменении значения pH раствора (при взаимодействии иона металла и трилона Б):
Me2+ + [ H2I ]2- [ MeI ]2- + 2H+ . (4)
Выделение H+ строго эквивалентно содержанию металла, поэтому раствор далее титруют 0,1н раствором NaOH с индикатором метил-оранжевым или метиловым-красным.