
- •1. Строение и свойства материалов
- •1.1. Кристаллические и аморфные тела
- •2. Элементы кристаллографии
- •1.2.1. Кристаллическая решетка
- •1.2.2. Анизотропия
- •1.2.3. Взаимодействие частиц в кристаллах
- •3. Фазовый состав сплавов
- •1.3.1. Твердые растворы
- •1.3.2. Промежуточные фазы
- •1.3.3. Дефекты кристаллов
- •Точечные дефекты
- •Линейные дефекты
- •Поверхностные дефекты
1.2.3. Взаимодействие частиц в кристаллах
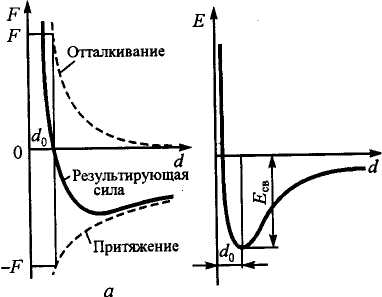
Частицы в кристалле сближаются на определенное расстояние, которое обеспечивает кристаллу наибольшую термодинамическую стабильность. Это расстояние d0 определяется равенством сил притяжения и отталкивания между частицами, при этом достигается минимум энергии связи, что и делает кристалл термодинамически стабильным.
Природа сил притяжения определяется природой частиц, составляющих кристалл. Так, в случае молекулярных кристаллов (см. ниже) - это силы Ван-дер-Ваальса (ориентационные, индукционные и дисперсионные). В ионных кристаллах - это силы электростатического взаимодействия катионов и анионов.
Природа сил отталкивания имеет электростатических характер, это взаимодействие одноимённых зарядов – электронных орбиталей друг с другом и соседних атомных ядер.
Силы отталкивания проявляются при сильном сближении частиц и растут
интенсивнее, чем силы притяжения (рис.4).
б
Рис..4. Изменение силы (а) и энергии взаимодействия (б) при сближении атомов в кристалле.
Тип связи, возникающий между частицами в кристалле, определяется их электронным строением. Энергия связи для различных кристаллов приведена ниже:
Кристалл |
Аг СН4 |
Алмаз SiC |
LiF NaCl |
Fe Na |
Энергия, кДж/моль |
7,5 10 |
750 1180 |
1000 750 |
390 110 |
Тип связи |
Молекулярная |
Ковалентная |
Ионная |
Металлическая |
Она определяет температуру плавления, модуль упругости, температурный коэффициент линейного расширения и др.
Среди кристаллов распространено явление полиморфизма — способность в твердом состоянии при различных температурах (или давлении) иметь различные типы кристаллических структур. Эти кристаллические структуры называют аллотропическими формами, или модификациями. Низкотемпературную модификацию называют , а высокотемпературные — , , и т.д.
3. Фазовый состав сплавов
Термин «сплав» в настоящее время имеет более широкое значение, чем во время его появления. Если раньше промышленные материалы, содержащие несколько элементов, получали преимущественно путем сплавления, то сейчас для этого используют различные технологические способы. Это порошковая металлургия (прессование твердых частиц и их последующее спекание при высоких температурах), диффузионный метод (проникновение одного вещества в другое твердое вещество при высоких температурах), плазменное напыление, кристаллизация из паров в вакууме, электролиз и т.д.
Преимущественное использование в промышленности находят сплавы металлов с металлами или неметаллами. В сплавах элементы могут по-разному взаимодействовать между собой, образуя различные по химическому составу, типу связи и строению кристаллические фазы.
Фазой называется однородная, отделенная поверхностью раздела, часть металла или сплава, имеющая одинаковые состав, строение и свойства. В зависимости от атомно-кристаллической структуры различают твердые растворы и промежуточные фазы.
Твердыми растворами называются кристаллы, в которых сохраняется тип кристаллической решетки элемента-растворителя. В промежуточных фазах образуется новый тип кристаллической решетки, отличающийся от решеток элементов, его образующих.
Таким образом, помимо классификации кристаллов по видам связи используют классификацию по типам кристаллической решетки, которая позволяет прогнозировать характер изменения свойств сплава в зависимости от химического состава.
