- •Правила техники безопасности при работе с кислотами и щелочами.
- •Техника безопасности при работе с легковоспламеняющимися жидкостями.
- •Оказание первой медицинской помощи при ожогах и отравлениях химическими веществами.
- •Лабораторная работа № 2. Качественные реакции на аминокислоты.
- •Свойства аминокислот.
- •Лабораторная работа №2.
- •Лабораторная работа №3. Количественное определение белка по биуретовой реакции.
- •Лабораторная работа №5.
- •Лабораторная работа №7. Получение дезоксирибонуклеопротеида (дрнп).
- •Лабораторная работа №8. Выделение рибонуклеопротеидов (рнп).
- •Качественные реакции на рнп. Реакция с дифениламином на рибозу.
- •Реакция на пентозу (рибозу) с орцином.
Правила техники безопасности при работе в биохимической лаборатории.
Многие вещества, используемые, в биохимии являются токсичными, легковоспламеняющимися и ядовитыми. Поэтому при проведении даже самого простого опыта необходимо знать и строго соблюдать следующие правила:
Категорически запрещается работать в лаборатории одному, так как в экстренном случае будет некому оказать первую помощь пострадавшему и ликвидировать последствия неудавшегося эксперимента. Работать следует только в отведенное время под контролем преподавателя или лаборанта кафедры.
Необходимо соблюдать тишину, чистоту и порядок. Поспешность и неряшливость в работе часто приводят к несчастным случаям. Нельзя отвлекаться и отвлекать от работы своих товарищей. Запрещается держать на лабораторном столе посторонние предметы (сумки, книги и т.п.)
Категорически запрещается принимать и хранить пищу, пить и курить.
Каждый должен знать, где находятся средства индивидуальной защиты, аптечки, средства для тушения пожара.
В лаборатории необходимо находиться в застегнутом хлопчатобумажном халате. Это обеспечивает некоторую индивидуальную защиту, а так же препятствует загрязнению одежды.
Приступать к работе можно только после усвоения всей техники ее выполнения. Если вы испытываете какие-либо сомнения в методике проведения эксперимента или в технике безопасности, прежде чем продолжать работу, проконсультируйтесь с преподавателем или лаборантом.
Нельзя проводить опыт в загрязненной посуде. Посуду следует мыть сразу после проведения опыта.
Категорически запрещается пробовать химические вещества на вкус. Нюхать вещества следует осторожно, не поднося сосуд близко к лицу, а лишь направляя к себе пары или газы легким движением руки, при этом не следует делать полный вдох. Жидкие вещества и растворы запрещается набирать в пипетку ртом, для этого используются специальные приспособления.
В процессе работы необходимо следить, чтобы реактивы не попадали на кожу, так как многие из них вызывают раздражение и ожоги кожи и слизистых оболочек.
Все сосуды с веществами должны быть снабжены этикетками с соответствующими названиями.
Запрещается нагревать, смешивать и взбалтывать реактивы вблизи лица. При нагревании нельзя держать пробирку или колбу отверстием к себе или направлять на товарищей и преподавателей.
Необходимо пользоваться защитными очками в следующих случаях:
А) при работе с едкими веществами (с концентрированными растворами кислот и щелочей и т.п.);
Б) при перегонке жидкостей при пониженном давлении и работе с вакуум-приборами;
В) при работе со щелочными металлами;
Г) при работе с ампулами и изготовлении стеклянных капеляров.
13. Запрещается выливать в раковину остатки кислот и щелочей, огнеопасных и взрывоопасных, а также сильно пахнущих веществ. Для слива этих веществ в вытяжном шкафу должны находиться специальные сосуды с плотно притертыми крышками и соответствующими этикетками («СЛИВ ОРГАНИКИ», «СЛИВ ЩЕЛОЧЕЙ», «СЛИВ КИСЛОТ»).
14. Нельзя бросать в раковину стекла от разбитой посуды, бумагу и вату.
15. После работы необходимо выключить газ, воду и электроэнергию.
Правила техники безопасности при работе с кислотами и щелочами.
Хранить концентрированные кислоты и щелочи следует в вытяжном шкафу в прочной стеклянной посуде на поддоне.
Все работы с кислотами и щелочами нужно проводить в защитных очках.
Концентрированную соляную и азотную кислоты можно переливать только в вытяжном шкафу. Разбавление кислот следует проводить в жаростойкой посуде, при этом кислоту надо приливать к воде небольшими порциями , при перемешивании (нельзя приливать воду к концентрированной кислоте, так как в этом случае выделяется большое количество теплоты, вода, как менее плотное вещество, вскипает на поверхности кислоты, и жидкость может быть выброшена из сосуда).
При растворении гидроксидов натрия и калия кусочки щелочи можно брать только пинцетом или шпателем, но не руками! Растворение этих веществ следует проводить небольшими порциями.
Техника безопасности при работе с легковоспламеняющимися жидкостями.
Работы с легковоспламеняющимися жидкостями (ЛВЖ) следует проводить подальше от огня. Запрещается нагревать летучие и ЛВЖ (ацетон, эфиры, спирты, петролейный эфир, бензин, бензол, сероуглерод) на открытом пламени. Для нагревании ЛВЖ можно использовать водяную баню или электрическую плитку с закрытой спиралью, при этом сосуд должен быть снабжен водяным холодильником.
Перегонять ЛВЖ следует в приборе с водяным холодильником или на роторном испарителе. Нельзя перегонять жидкости досуха – это может привести к взрыву и пожару. Приборы, содержащие ЛВЖ, следует разбирать после удаления всех источников пламени и полного охлаждения сосуда.
Категорически запрещается выливать ЛВЖ в канализацию, ведра и ящики для мусора, так как случайно брошенная спичка может вызвать пожар.
ЛВЖ должны храниться в металлических шкафах в количествах, не превышающих ежедневных потребностей.
Оказание первой медицинской помощи при ожогах и отравлениях химическими веществами.
При термических ожогах первой степени (краснота и припухлость) обожженное место надо обработать спиртовым раствором танина, 96 % этиловым спиртом или раствором перманганата калия. При ожогах второй и третьей степени (пузыри и язвы) допустимы лишь обеззараживающие примочки из раствора перманганата калия, после чего необходимо обратиться к врачу.
При ожогах кислотами необходимо промыть пораженное место большим количеством проточной воды, а затем 3% раствором гидрокарбоната натрия, после чего снова водой.
При ожогах щелочами нужно промыть пораженный участок проточной водой, а затем сильно разбавленным раствором борной или уксусной кислоты.
При попадании щелочи или кислоты в глаза необходимо промыть их проточной водой (3-5 мин), а затем раствором борной кислоты (в случае попадания щелочи) или гидрокарбоната натрия (в случае попадания кислоты), после чего обратиться к врачу.
При ожогах фенолом очаг поражения следует обработать 70% этиловым спиртом, а затем глицерином до исчезновения белых пятен на коже. При отравлении парами фенола категорически запрещается пить молоко!
При ожогах бромом его нужно смыть 96% этиловым спиртом или разбавленным раствором щелочи, после чего место поражения смазать мазью от ожогов и обратиться к врачу. При отравлении парами брома необходимо несколько раз глубоко вдохнуть пары этилового спирта, а затем выпить молока.
При попадании на кожу едких органических веществ, не растворимых в воде, их необходимо смыть большим количеством подходящего растворителя. После оказания первой помощи пострадавший должен быть направлен в медпункт.
Лабораторная работа №1
Разделение смеси аминокислот методом радиальной хроматографии.
Для разделения смеси аминокислот, находящихся в гидролизате белка, и качественного обнаружения отдельных аминокислот широко применяют метод распределительной хроматографии на бумаге. Этот метод представляет собой одну из модификаций метода хроматографического анализа, предложенного М.С.Цветом в 1903г.
Аминокислоты обладают различной растворимостью в двух частично смешивающихся жидкостях, одной из которых является вода, а второй - органический растворитель.
Реактивы и оборудование: растворы аминокислот (0,1М) лизина, аланина, фенилаланина и неизвестной исследуемой смеси аминокислот; растворитель (БУВ) – бутанол, уксусная кислота, вода в соотношении 15:3:7, нингидрин (0,5%) в ацетоне (95%); чашки Петри, хроматографическая бумага или фильтровальная бумага (синяя или красная лента), капилляры, ножницы, карандаш, линейка, сушильный шкаф, пинцет, фарфоровая ванночка.
Ход работы: Из хроматографической бумаги вырезают диск, диаметром на
|
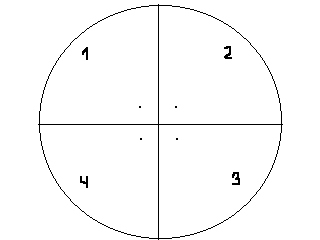
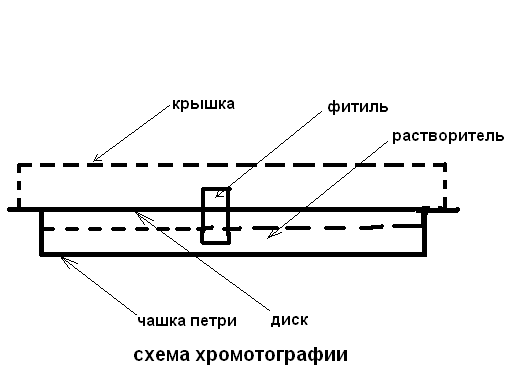
1 см больше чем диаметр чашки Петри. Диск карандашом делят на 4 равные части. Каждый сектор нумеруют. В 1 см от центра диска на каждом секторе ставят точку - “точка старта„(см рис.). Затем в центре диска проделывают отверстие диаметром 5-6 мм. В это отверстие вставляют трубочку, плотно скрученную из фильтровальной бумаги, высотой ≈3 см. Диск с трубочкой помещают на чашку Петри так, чтобы он лежал на краях чашки.
|
 В
каждую точку старта капеляром наносят
небольшое количество раствора аминокислот:
аланина (сектор №1), лизина (сектор №2),
фенилаланина (сектор №3). В сектор №4
наносят исследуемую смесь.
В
каждую точку старта капеляром наносят
небольшое количество раствора аминокислот:
аланина (сектор №1), лизина (сектор №2),
фенилаланина (сектор №3). В сектор №4
наносят исследуемую смесь.
В чашку Петри наливают растворитель, так чтобы он закрывал дно на 5-7 мм. Затем устанавливают на чашку диск, при этом бумажная трубочка должна погрузиться в жидкость, сверху диск накрывают крышкой (другой чашкой Петри). Оставляют хромотографический сосуд под тягой на 30-40 мин.
По фитилю растворитель поднимается вверх и распределяется по окружности бумажного диска, увлекая за собой аминокислоты. При этом происходит разделение исследуемой смеси на отдельные аминокислоты, движущиеся с разной скоростью, соответственно их коэффициентам распределения.
Когда фронт растворителя дойдет почти до края бумажного диска, крышку снимают и на нее кладут диск. Отмечают границу фронта карандашом. Хроматограмму подсушивают под тягой, а затем помещают на несколько минут в сушильный шкаф при температуре 70˚ С для полного устранения растворителя и фиксации аминокислот.
Для выявления аминокислот хроматограмму опрыскивают раствором нингидрина (либо сухую хроматограмму быстро одним движением протягивают через раствор нингидрина, налитым в плоскую неглубокую фарфоровую кювету). Обработанную таким образом хроматограмму сушат под тягой до полного испарения раствора, а потом помещают в сушильный шкаф на 1-2 минуты при температуре 70˚ С. Если все было сделано правильно, то на диске проступают красно-фиолетовые пятна, окрасившихся аминокислот.
Идентификацию аминокислот проводят по сопоставлению позиций индивидуальных аминокислот и их смеси. Для каждой аминокислоты рассчитывают подвижность (Rf) по формуле: Rf=a/b, где a – расстояние в миллиметрах, пройденное аминокислотой от точки старта до середины ее пятна, b – расстояние в миллиметрах, пройденное растворителем от точки старта до фронта. Сравнивают Rf известных аминокислот с Rf аминокислот, полученных из исследуемой жидкости и определяют наличие конкретных аминокислот в смеси.