
- •060108 «Фармация», 2 курс, III семестр
- •1. Анионы
- •1.2. Первая группа анионов.
- •1.2.1. Аналитические реакции сульфат - иона so42.-
- •1.2.2. Аналитические реакции сульфит – иона so32.-
- •1.2.3 Аналитические реакции тиосульфат – иона s2o32-.
- •1.2.4. Аналитические реакции карбонат-иона co32-.
- •1.2.5. Аналитические реакции фосфат-иона po43-.
- •1.2.6. Аналитические реакции оксалат-иона c2o42-.
- •1.2.6. Аналитические реакции тетраборат-иона в4о72-.
- •Аналитические реакции анионов I группы
- •1.3. Вторая группа анионов.
- •1.3.1. Аналитические реакции хлорид-иона Cl-.
- •1.3.2. Аналитические реакции бромид-иона Br- .
- •1.3.3. Аналитические реакции иодид-иона I-.
- •1.3.4. Аналитические реакции сульфид-иона s2-.
- •Сероводород ядовит!
- •1.3.5. Аналитические реакции тиоцианат-иона scn-.
- •1.4. Третья группа анионов.
- •1.4.1. Аналитические реакции нитрит-иона no2-.
- •1.4.1. Аналитические реакции нитрат-иона no3-.
- •1.4.2. Аналитические реакции ацетат-иона ch3coo-.
- •Вопросы для самоподготовки
- •Вопросы для самоконтроля
- •Основная литература
1.3.5. Аналитические реакции тиоцианат-иона scn-.
SCN- -анион сильной роданистоводородной кислоты, обладает в кислых средах восстановительными свойствами.
Реакция с нитратом серебра AgNO3. Тиоцианат-ион при взаимодействии с катионами серебра образует белый творожистый осадок тиоцианата серебра AgSCN:
SCN- + Ag+ AgSCN
Осадок растворим в NH3H2O, Na2S2O3, KCN и в избытке SCN-ионов:
AgSCN + 2NH3 [Ag(NH3)2]+ + SCN-
AgSCN + nS2O32- [Ag(S2O3)n]1-2n + SCN- (n = 2,3)
AgSCN + 2CN- [Ag(CN)2]- + SCN-
AgSCN- + nSCN- [Ag(SCN)n]1-n
Выполнение реакции: к 2-3 каплям AgNO3 приливают по каплям раствор тиоцианата калия или аммония до прекращения образования белого осадка AgSCN, а затем избыток тиоцианата до растворения образовавшегося осадка.
Реакция с солями железа(III) или кобальта (II). Реакция основана на способности тиоцианат-иона образовывать с катионами металлов Fe(III) и Co(II) устойчивые окрашенные тиоцианатные комплексы:
Fe3+ + 6SCN- [Fe(SCN)6]3-– красный цвет
Co2+
+ 4SCN-
![]() [Co(SCN)4]2-
- сине-голубой цвет
[Co(SCN)4]2-
- сине-голубой цвет
Выполнение реакции: смотри в аналитических реакциях на катионы Fe3+ и Co2+.
Реакция с иодат-ионами IO3- (проводить под тягой!). Тиоцианат-ионы в кислой среде выделяют из иодатов свободный иод, обнаруживаемый по посинению крахмала:
5 SCN- + 6IO3- + H+ + 2H2O 5SO42- + 5HCN + 3I2
Проведению реакции мешают анионы-восстановители.
Выполнение реакции: реакцию проводят на крахмальной бумаге. Для этого фильтровальную бумагу пропитывают свежеприготовленным раствором крахмала и высушивают. На нее наносят каплю раствора HCl, каплю KSCN и каплю KJO3. Бумага окрашивается в синий цвет вследствие образования иод-крахмального комплекса синего цвета.
1.4. Третья группа анионов.
Характеристика группы. К третьей аналитической группе анионов относятся нитрат-ион NO3-, нитрит-ион NO2-, ацетат-ион CH3COO- и др. Серебряные и бариевые соли этих анионов растворимы в воде, вследствие чего ни AgNO3, ни BaCl2, не осаждают анионы третьей группы. Группового реагента у этой группы нет.
Определение нитритов и нитратов имеет большое значение для исследования питьевой воды. Наличие большого количества нитритов и нитратов является показателем загрязнения и непригодности воды для питья.
1.4.1. Аналитические реакции нитрит-иона no2-.
Нитрит-ион является анионом слабой (рК=3,29) и нестойкой азотистой кислоты. Нитриты устойчивее азотистой кислоты, все они хорошо растворимы в воде. Нитрит-ион редокс-амфотерен, что используется в анализе.
Фармакопейная. Реакция с кислотами. При взаимодействии с кислотами нитриты выделяют свободную азотистую кислоту:
2KNO2 + H2SO4 2HNO2 + K2SO4
Азотистая кислота нестойкая и разлагается на оксиды и воду:
2HNO2 NO2 + NO + H2O
Пары выделяющегося диоксида азота имеют бурый цвет и хорошо заметны на белом фоне.
Выполнение реакции: в пробирку с 3-4 каплями раствора нитрита калия прибавляют 3-4 капли растовра серной кислоты. На белом фоне в пробирке наблюдается выделение бурого газа.
Реакция окисления нитрит-ионом иодид-иона. Нитрит-ион в кислой среде окисляет иодид-ион до свободного йода, который окрашивает хлороформ или бензол в красновато-фиолетовый цвет:
2KNO2 + 2KI + 2H2SO4 I2 + 2NO + 2H2O + 2K2SO4
Выполнение реакции: к 3-4 каплям раствора KNO2 прибавляют 1-2 капли 2моль/дм3 раствора H2SO4, несколько капель бензола или хлороформа и 1-2 капли KI. Пробирку энергично встряхивают и наблюдают появление красновато-фиолетовой окраски слоя органического растворителя.
Фармакопейная. Реакция с дифениламином. Нитрит-оин окисляет дифениламин (I) в среде концентрированной серной кислоты до дифенилбензидина (II), а затем до хиноидного соединения (III) синего цвета:
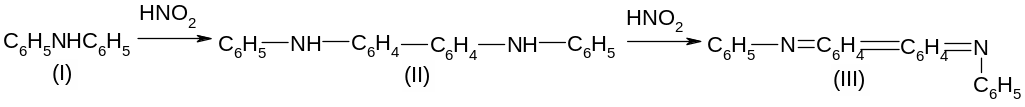 Нитрат-ион
NO3- дает
аналогичную реакцию с дифениламином.
Нитрат-ион
NO3- дает
аналогичную реакцию с дифениламином.
Выполнение реакции. На чистую сухую стеклянную пластинку наносят 2-3 капли раствора дифениламина в концентрированной серной кислоте и каплю NaNO2. Смесь окрашивается в ярко синий цвет.
Реакция этакридина (риванола) с нитрит-ионами в кислой среде образует диазоэтакридин красного цвета:
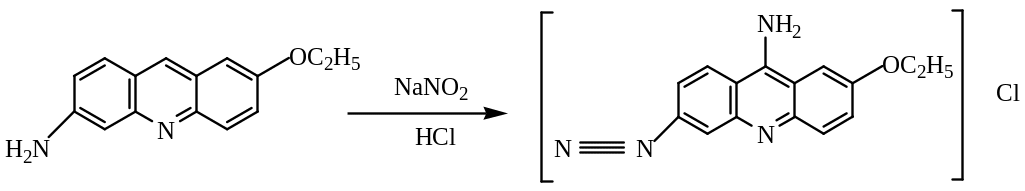
Реакция специфична для нитритов.
Выполнение реакции: в пробирку к 3-4 каплям раствора NaNO2 прибавляют 3-4 капли раствора этакридина. Наблюдают образование красного диазосоединения.
Фармакопейная. Реакция с антипирином. Нитрит-ион в кислой среде (HCl, H2SO4) образуют с антипирином нитрозоантипирин изумрудно-зеленого цвета:

антипирин нитрозоантипирин
Выполнение реакции: в пробирку помещают 3-4 капли раствора NaNO2, прибавляют 3-4 капли раствора антипирина и каплю концентрированной HCl (H2SO4). Наблюдают образование нитрозоантипирина изумрудно-зеленого цвета.
Реакция Грисса. Смесь сульфаниловой
кислоты с
![]() -
нафтиламином (реактив Грисса – Илошвая)
при взаимодействии с нитрит-ионом в
нейтральных или уксуснокислых растворах
образуется азокраситель ярко-красного
цвета:
-
нафтиламином (реактив Грисса – Илошвая)
при взаимодействии с нитрит-ионом в
нейтральных или уксуснокислых растворах
образуется азокраситель ярко-красного
цвета:
HO3S−C6H4−NH2 + HNO2 + CH3COOH [HO3S–C6H4–N≡N] CH3COO + 2H2O
ярко-красный
Выполнение реакции: на стеклянную пластинку наносят 2 капли нейтрального или уксуснокислого раствора NaNO2, прибавляют по капле растворы сульфаниловой кислоты и -нафтиламина (или 1-амино-2-нафтола). Образуется азокраситель ярко-красного цвета. Нитрат-ион такой реакции не дает
Фармакопейный тест. Реакция с перманганатом калия. Нитрит-ион в данной реакции проявляет восстановительные свойства и обесцвечивает раствор KMnO4.
5NO2- + 2MnO4- + 6H+ 5NO3- + 2Mn2+ + 3H2O
Нитрат-ион NO3- не обесцвечивает раствор KMnO4.
Выполнение реакции: в пробирку вносят 1-2 капли разбавленного раствора KMnO4, прибавляют 1-2 капли разбавленной серной кислоты и 3-4 капли раствора NaNO2. Розовый раствор KMnO4 обесцвечивается.
