
- •Глава 6
- •6.1. Энтропия. Энтропия идеального газа
- •6.2. Второе начало термодинамики
- •6.3. Необратимые процессы
- •6.4. Закон возрастания энтропии и необратимость времени
- •6.5. Статистическая интерпретация второго начала термодинамики
- •6.6. Энтропия как мера беспорядка молекулярной системы
- •6.7. Энтропия и информация
- •6.8. Третье начало термодинамики
- •6.9. Открытые термодинамические системы
- •6.10. Условия термодинамического равновесия
- •6.11. Понятие об отрицательной абсолютной
6.3. Необратимые процессы
Заметим, что утверждения обеих частных формулировок второго закона термодинамики не противоречат закону сохранения и превращения энергии (первому началу термодинамики). Существуют и другие процессы, которые не противоречат первому началу термодинамики и, тем не менее, в природе никогда не происходят. Если, например, в сосуде, одна половина которого заполнена газом, убрать перегородку, газ займет весь объем сосуда (расширится в пустоту). Противоположный процесс не происходит: газ сам по себе не сконцентрируется в одной половине сосуда, сам по себе газ может только расширяться, но не сжиматься. Другой пример. Если в двух половинах сосуда находятся газы разной природы, то при открытии перегородки газы полностью перемешаются. Обратный же процесс – самопроизвольное разделение газов не наблюдается никогда. Такого же типа является пример самолета, выписывающего в небе дымом слова. Буквы с течением времени размываются и исчезают, не собираясь никогда вновь. Не противоречило бы первому началу термодинамики и если бы какое-то тело приобрело кинетическую или потенциальную энергию только за счет убыли внутренней энергии самого тела и окружающей среды.
Вообще, все
многообразие процессов, происходящих
в природе, можно разделить на две группы:
самопроизвольные и несамопроизвольные.
Самопроизвольные процессы идут сами
собой; для их протекания не только не
затрачивается работа, но они сами, будучи
поставленными в соответствующие условия,
могут произвести работу (например,
падающая с плотины вода вызывает вращение
колеса турбины). Самопроизвольными
являются выше рассмотренные процессы
выравнивания температур, давлений,
плотностей в газе; переход механической
энергии во внутреннюю энергию, процесс
расширения газа в пустоту и др. Процесс,
обратный по отношению к самопроизвольному
процессу, является несамопроизвольным
процессом. А поскольку все процессы,
которые могут самопроизвольно протекать
только в одном направлении, являются
процессами необратимыми,
то все
самопроизвольные процессы являются
процессами необратимыми.
Обратимыми,
как уже отмечалось, являются все
равновесные процессы, а необратимыми
– все неравновесные. Поэтому неравенства
(6.9) можно рассматривать и как критерий
обратимости или необратимости процесса:
процесс является обратимым, если при
его протекании энтропия системы остается
неизменной (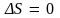 ),
и необратимым, – если энтропия возрастает
(
),
и необратимым, – если энтропия возрастает
(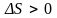 ).
).
Покажем на примере обратимого изотермического расширения газа, при котором его объем изменяется от V1 до V2, что полное изменение энтропии равно нулю. Изменение энтропии газа равно
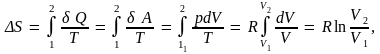
(6.11)
поскольку dU = 0 при постоянной температуре T. Найдем теперь изменение энтропии окружающих тел. Очевидно, что
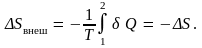
Таким
образом, оно в точности равно изменению
энтропии газа, взятому с обратным знаком.
Следовательно, полное изменение энтропии
в этом процессе
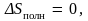 ибо положительное и отрицательное
изменения энтропии газа и окружающих
тел компенсируют друг друга. Полученное
равенство представляет собой точное
выражение условия обратимости процесса.
ибо положительное и отрицательное
изменения энтропии газа и окружающих
тел компенсируют друг друга. Полученное
равенство представляет собой точное
выражение условия обратимости процесса.
Проведенное
рассмотрение позволяет установить
различие
в понятиях «обратимый» в механическом
смысле и термодинамическом. При
механических движениях энтропия остается
все время постоянной (равной нулю). При
термодинамических же процессах энтропия
системы может изменяться. Но это изменение
в любой момент в точности компенсируется
противоположным по знаку изменением
энтропии окружающих систему тел. Однако
в случае адиабатных обратимых процессов
это различие между механической и
термодинамической системами исчезает,
так как в этом случае не только

Покажем теперь на примере необратимого процесса смешения газов, что при необратимых процессах энтропия возрастает. Рассмотрим два газа, находящихся в равных объемах V сосуда, разделенного перегородкой при одинаковом давлении p и температуре T. Если убрать перегородку, то газы начнут смешиваться, в результате чего каждый из них займет объем 2V. В образовавшейся смеси давление каждого газа будет равно 1/2p. Будем предполагать для простоты, что количество каждого газа равно одному молю. Для энтропии одного моля газов до смешения, согласно формуле (6.4), имеем
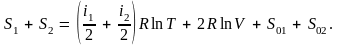
Энтропию после смешения можно вычислить как сумму энтропии обеих компонент смеси, т.е.
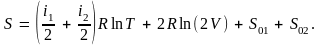
Таким образом, изменение энтропии равно
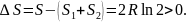
Энтропия возрастает. Заметим, что полученный результат не зависит от природы газов, поэтому приращение энтропии будет одинаково для любой пары газов.
В проведенном выше рассмотрении существенно, что смешиваются разные газы, Если же распространить полученную формулу на одинаковые газы, то мы приходим к так называемому парадоксу Гиббса, состоящему в том, что удаление перегородки в сосуде, которое в случае одинакового газа в обеих половинах не вызывает никаких необратимых процессов, сопровождается возрастанием энтропии. Парадокс Гиббса разрешается тем, что только для разных газов справедливы проведенные выше выкладки.
Утверждение о том, что любой реальный самопроизвольный процесс является необратимым, часто называют обобщенной формулировкой второго начала термодинамики. Так, невозможность совершения работы за счет всего количества теплоты, полученного от нагревателя (первая частная формулировка второго закона термодинамики), связана с необратимостью тепловых процессов. Если бы энергия могла самопроизвольно переходить от охладителя к нагревателю, то работа совершалась бы за счет всего количества теплоты, полученного от нагревателя.
Все самопроизвольные (естественные) процессы ведут систему к состоянию равновесия, в котором энтропия системы принимает максимальное значение. Если система достигла состояния с максимальной энтропией, то в ней не могут протекать уже никакие дальнейшие процессы, ибо любой процесс приводил бы систему к уменьшению энтропии, а это невозможно. Следовательно, состояния с максимальной энтропией являются состояниями устойчивого термодинамического равновесия системы.
Следует отметить,
что с развитием статистической физики
выяснилось, что необратимость тепловых
процессов носит вероятностный характер.
Самопроизвольный переход системы из
равновесного состояния в неравновесное,
строго говоря, не невозможен, а лишь
подавляюще менее вероятен, чем переход
из неравновесного состояния в равновесное.
В конечном итоге необратимость тепловых
процессов обусловливается колоссальностью
числа частиц – молекул, из которых
состоит тело. Покажем это на рассмотренном
выше примере расширения газа в пустоту.
Каждая молекула газа при своем движении
в среднем проводит одинаковое время в
обеих частях сосуда; можно сказать, что
вероятность ее нахождения в каждой из
половин сосуда равна 1/2. Если газ
идеальный, то его молекулы движутся
независимо друг от друга. Поэтому
вероятность найти две данные молекулы
одновременно в одной половине сосуда
по теореме умножения вероятностей
составит 1/2∙1/2 = (1/2)2;
вероятность найти все N
молекул газа в одной половине сосуда
будет равна (1/2)N
=
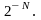 Так как число N
велико (~
Так как число N
велико (~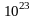 ),
то вероятность эта исчезающе мала.
),
то вероятность эта исчезающе мала.
