
- •4.1. Загальні уявлення про хімічний зв'язок
- •4.2. Іонний зв’язок
- •4.3. Ковалентний зв’язок
- •4.3.1. Теорія Льюїса
- •4.3.2. Метод валентних зв'язків
- •4.3.3. Валентність при ковалентному типу зв’язку
- •4.3.4. Просторова будова молекул
- •4.3.5. Гібридизація електронних хмар
- •4.3.6. Перекривання електронних хмар при кратних зв’язках
- •4.3.7. Теорія молекулярних орбіталей
- •4.3.8. Сучасна теорія хімічного зв’язку
- •4.4. Донорно-акцепторний зв’язок
- •4.5. Водневий зв’язок
- •4.6. Основні кількісні характеристики хімічного зв’язку
- •4.7. Типи взаємодії між молекулами
- •4.8. Типи хімічного зв’язку між частинками в кристалах
- •Питання для самоперевірки
4.3.4. Просторова будова молекул
Направленість ковалентного зв’язку забезпечує визначену просторову будову молекул. Розглянемо це положення на прикладі молекули води:

Електронна хмара єдиного електрона Гідрогену має сферичну форму, тому перекривання електронних хмар у нього рівноцінно за всіма напрямками. Отже, просторова будова молекули води має бути обумовлена напрямком
р-хмар Оксигену. Дві р-хмари Оксигену розташовані на взаємно перпендикулярних осях, на яких проходить перекривання s-хмарами Гідрогену (рис. 10).
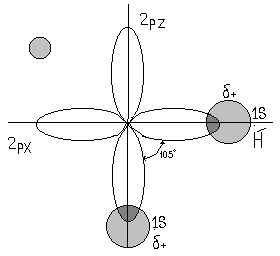
Рис. 10. Перекривання електронних хмар у молекулі води
Електронегативність Оксигену більша від електронегативності Гідрогену, зв'язок полярний, атоми Гідрогену мають позитивні ефективні заряди. Відбувається відштовхування однойменних зарядів. Кут між осями електронних хмар збільшується і замість 90о стає рівним 105о. Таким чином, молекула води має кутову форму (рис. 11).

Рис. 11. Кутова форма молекули води
4.3.5. Гібридизація електронних хмар
Уявлення про гібридизацію електронних хмар було запропоновано з метою пояснення протиріччя між різними формами електронних хмар неспарених електронів (s, p, d) і властивостями реальних молекул. Це протиріччя стає зрозумілим при розгляданні, наприклад, молекули BeCl2:
2s 2p
↑↓
↑ ↓
2p
– стабільний
cтан
2s 2p
2p
Be – 1s2
2s2
↑
↑
↑
– збуджений
стан
У стабільному стані берилій має валентність, що дорівнює нулю, у збудженому – двом. В утворенні зв’язку з хлором беруть участь сферична
s-хмара і гантелеподібна р-хмара. Перекривання електронних хмар s-р та р-р за довжиною і міцністю зв’язку не може бути рівноцінним. Внаслідок цього два атоми хлору в молекулі BeCl2 повинні бути нерівноцінними за реакційною здатністю. Насправді обидва атоми хлору однакові. Це явище пояснюється гібридизацією (змішуванням) електронних хмар різних конфігурацій (рис. 12).

Рис. 12. Схема sр-гібридизації
Із сферичної s-хмари й гантелеподібної р-хмари утворюються дві
sр-хмари, кожна з яких являє собою неправильну вісімку. Можливі різні типи гібридизації з участю d-електронів. Кожному типу гібридизації відповідає певна форма молекул: sр-гібридизація приводить до утворення лінійних молекул, sр3 – тетраедричних і т.п.
4.3.6. Перекривання електронних хмар при кратних зв’язках
Кратним називається зв’язок між двома атомами, утворений не однією, а двома або трьома поділеними парами електронів.
У творення
кратних зв’язків між атомами розглянемо
на прикладі молекули азоту N2:
творення
кратних зв’язків між атомами розглянемо
на прикладі молекули азоту N2:
У кожному атомі Нітроґену в хімічному зв’язку беруть участь три неспарені р-електрони, між атомами утворюється потрійний зв’язок, здійснений трьома поділеними парами електронів. Електронні хмари р-електронів розташовані у трьох взаємно перпендикулярних напрямках. Одна з трьох областей перекривання лежить на лінії однієї з осей електронних хмар, яка з’єднує ядра атомів Нітроґену. Цей зв’язок називається δ-зв’язком. Перекривання інших електронних хмар проходить перпендикулярно їх осям і має назву π-зв’язок (рис. 13).

Рис. 13. Перекривання електронних хмар при кратному
(потрійному) зв’язку в молекулі N2
Площина перекривання більша при δ-зв’язку, тому такий зв’язок міцніший ніж π-зв’язок. При хімічній взаємодії в першу чергу розривається
π-зв’язок.
