- •Статистична обробка даних аналізу об'єктів навколишнього середовища
- •Теоретичні відомості
- •Значень довірчої вірогідності р
- •Завдання для самостійної роботи
- •Запитання до самоперевірки:
- •Способи вираження концентрацій розчинів і алгоритм розрахунків при приготуванні розчинів заданої концентрації
- •Теоретичні відомості
- •100 Г розчину містить 20 г nh4Cl,
- •80Г розчину містить х г nh4Cl
- •159,6 Г CuSo4 міститься в 249,6 г CuSo4∙5h2o,
- •100Г CuSo4 міститься в х г CuSo4∙5h2o,
- •Завдання для самостійної роботи
- •Запитання до самоперевірки:
- •Методи хімічного аналізу
- •Хід роботи
- •Запитання до самоперевірки:
- •Фотометричне визначення концентрації речовини
- •Реактиви та обладнання:
- •Теоретичні відомості
- •Хід роботи
- •Запитання до самоперевірки:
- •Визначення іонів карбонату та бікарбонату у водній витяжці ґрунту
- •Обладнання та реактиви:
- •Теоретичні відомості
- •Хід роботи
- •Запитання до самоперевірки:
- •Визначення діоксиду карбону карбонатів
- •Обладнання та реактиви:
- •Теоретичні відомості
- •Хід роботи:
- •Теоретичні відомості
- •Хід роботи
- •Запитання до самоперевірки:
- •Визначення обмінної кислотності ґрунту
- •Обладнання та реактиви
- •Теоретичні відомості
- •Хід роботи
- •Запитання до самоперевірки
- •Визначення гідролітичної кислотності за методом Каппена в модифікації цінао
- •Обладнання та реактиви:
- •Хід роботи
- •Запитання до самоперевірки:
- •Визначення і оцінка кислотно-основної буферності ґрунту
- •Реактиви та обладнання
- •Теоретичні відомості
- •За діапазонами значень рН
- •Хід роботи
- •Запитання до самоперевірки:
- •Визначення суми поглинутих основ за методом Каппена та ступеню насичення ґрунту основами
- •Обладнання та реактиви:
- •Теоретичні відомості
- •Хід роботи
- •Запитання до самоперевірки:
- •Визначення хлоридів у ґрунті
- •Обладнання та реактиви:
- •Теоретичні відомості
- •Хід роботи
- •Контрольні питання
- •Визначення вмісту Cu, Zn, Cr, Fe у воді методом атомно-абсорбційної спектрофотометрії
- •Обладнання та реактиви:
- •Хід роботи
- •Запитання до самоперевірки
- •Фотометричне визначення Феруму з сульфосаліциловою кислотою
- •Обладнання та реактиви:
- •Загальні відомості:
- •Хід визначення
- •Запитання до самоперевірки:
- •Визначення вмісту нітратів у сільськогосподарській продукції
- •Обладнання та реактиви:
- •Теоретичні відомості
- •Суть методу
- •Хід роботи
- •Запитання до самоперевірки:
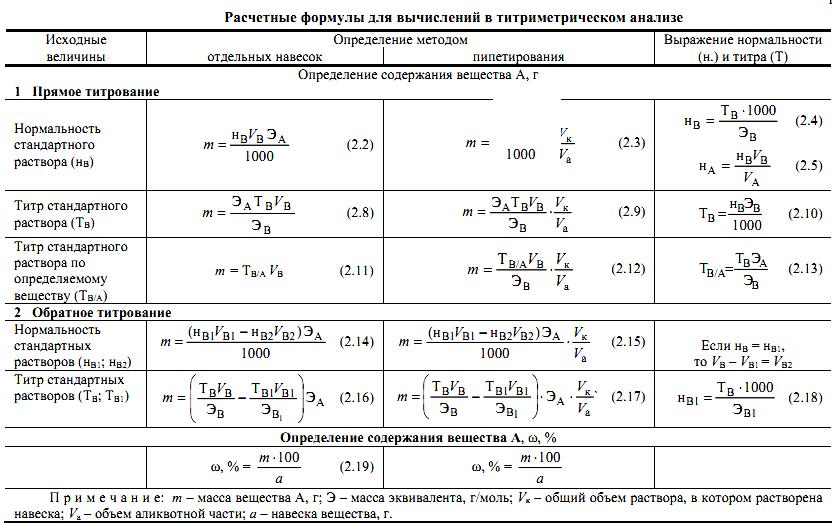
Теоретичні відомості
Титрометричний аналіз ґрунтується на точному вимірюванні об'єму розчину реагенту точно відомої концентрації, який витрачається в реакції з еквівалентною кількістю речовини, яку визначають.
Основні операції титрометричного аналізу:
а) приготування розчинів стандартної і аналізованої речовин;
б) титрування;
в) обчислення.
Титрування – це процес визначення концентрації речовини А поступовим додаванням невеликих кількостей речовини Б, при якому забезпечується виявлення точки, коли вся речовина А прореагувала. Розчин, що містить активний реагент, за допомогою якого проводять титрування, називається титрантом (Б). Титрант поміщують у бюретку, а розчин, який титрують – титрований розчин – у колбу.
Розчин титрантів зазвичай готують з стандарт-титрів. Відсутність стандарт-титрів, як правило, призводить до помилок, тому в лабораторній практиці застосовують коригувальні методи –стандартизація розчину титранту.
Хімічні реакції, що застосовуються в титрометричному аналізі, повинні відповідати таким вимогам:
реакція повинна протікати з достатньою швидкістю і бути практично незворотною;
взаємодія між досліджуваною речовиною і титрантом має відбуватися стехіометрично, з чітким фіксуванням кінцевої точки титрування;
у розчині не повинно бути речовин, що заважають перебігу основної реакції або фіксуванню кінцевої точки титрування.
Момент титрування, коли додана кількість речовини титранта хімічно еквівалентна (в найпростішому випадку рівна) кількості титрованої речовини, називається точкою еквівалентності (ТЕ). Терміни стехіометрична точка, кінцева точка титрування, точка еквівалентності – це синоніми.
фіксація точки еквівалентності є одним з відповідальних моментів у титрометричному методі. Методи визначення точки еквівалентності:
з допомогою спеціальних індикаторів;
за забарвленням реагуючих речовин;
за допомогою приладів.
В якості індикаторів часто використовують органічні барвники, забарвлення яких змінюється при досягненні кінцевої точки титрування. В табл. 2 наведені області переходу забарвлення деяких рН-індикаторів.
Таблиця 2 – області переходу забарвлення деяких рН-індикаторів
Індикатор |
забарвлення кислотної форми |
забарвлення лужної форми |
Область переходу рН |
Фенолфталеїн |
безбарвний |
Червоний |
8,0-10,0 |
Лакмус |
Червоний |
Синій |
5,0-8,0 |
Метиловий оранжевий |
Рожевий |
Жовтий |
3,1-4,4 |
Метиловий червоний |
Червоний |
Жовтий |
4,2-6,2 |
застосування індикаторів іноді виявляється складним або зовсім неможливим, наприклад, при титруванні мутних, сильно забарвлених або дуже розбавлених розчинів. А для деяких реакцій взагалі не знайдені відповідні індикатори. У таких випадках використовуються фізико-хімічні методи, тобто в ході титрування спостерігаються не зміна забарвлення індикатора, а зміна електрохімічних показників розчину, що титрується: електропровідності (кондуктометричне титрування), окисно-відновного потенціалу (потенціометричне титрування) тощо. Точка еквівалентності визначається не шляхом візуального спостереження за зміною забарвлення індикатора, а з використанням спеціального приладу, що дає об'єктивні результати.
Класифікація методів титрометричного аналізу. Методи титрометричного аналізу класифікують:
а) за прийомами виконання операцій (пряме, непряме і обернене титрування – титрування залишку, титрування замісника, реверсивне титрування);
б) за типом аналітичної реакції: кислотно-основне титрування або протолітометрія, окисно-відновне або редоксометрія, осаджувальне і комплексометричне титрування.
При прямому титруванні – розчин, який містить речовину X, безпосередньо титрують розчином точно відомої концентрації речовини А.
Зворотне титрування. До розчину, який містить речовину X, додають стандартний розчин А у надлишку. Залишок першого стандартного розчину, який не прореагував, титрують стандартним розчином В.
Титрування замісника. Речовину Х заміщують еквівалентною кількістю іншої речовини, яку потім титрують. В тих випадках, коли неможливо зафіксувати ТЕ, використовують титрування замісника. Наприклад, в йодометрії при визначенні окисників.
Техніка титрування (2 способи).
Піпеткування. наважку речовини, яку визначають, розчиняють в мірній колбі, потім беруть піпеткою аліквоту і титрують речовину, що визначають. При розрахунках враховують, що титрували тільки частину розчину, тому вводять множник Vмн./Va.
Спосіб окремих наважок. Наважку речовини, яку визначають, розчиняють в мірній колбі і титрують весь розчин.
Переваги титрометричного аналізу: швидкість визначення, простота обладнання, висока точність, можливість автоматизації аналізу.
Характерні помилки при титруванні наступні:
погрішність при встановленні концентрації титранта;
використання непідходящого індикатора;
суб'єктивні причини при виявленні зміни кольору;
рівноваги в розчині, що конкурують.
Усунення помилок проводять такими способами:
перевірка (регулярна) титру титранта;
використання декількох індикаторів;
статистична обробка результатів аналізу.