
Колоидная
.pdf
Порядок виконання роботи
1.Заповнити прилад Бертона (див. рис. 10.1):
a)в U-подібну трубку залити бокову рідину приблизно на половину об’єму приладу;
b)відкривши кран, прилад нахилити таким чином, щоб бокова рідина повністю заповнила вузьку трубку, і закрити кран;
c)прилад Бертона закріпити у штативі, фільтрувальним папером забрати залишки бокової рідини, що залишилася у вузькій трубці до крана, залити у лійку діалізований золь гідроксиду заліза, ледь відкрити кран, щоб приладу заповнювався повільно і зберігалася межа поділу золь гідроксиду заліза – бокова рідина. Коли межа поділу золь гідроксиду заліза – бокова рідина досягне положення А–А, закрити кран.
2.Вставити електроди в U-подібну трубку і U-подібною лінійкою виміряти відстань між електродами.
3.Електроди приєднати до джерела постійного струму і зафіксувати час початку досліду (включити секундомір).
4.Вольтметром виміряти різницю потенціалів, подану на електроди.
5.Коли межа поділу золь гідроксиду заліза – бокова рідина переміститься на 0,01 – 0,015м, дослід припиняють, зафіксувавши час його проведення (виключити секундомір).
6.Розрахувати -потенціал за рівнянням Гельмгольца – Смолуховського (10.1).
7.За напрямком зміщення кольорової межі поділу золь гідроксиду заліза – бокова рідина визначити заряд колоїдної частинки міцели золю гідроксиду заліза.
Опрацювання результатів
Електрокінетичний, або ζ-потенціал розраховують за рівнянням (10.1), використовуючи рівняння (10.2) і (10.3) для визначення електрофоретичної рухливості.
У загальну похибку проведення експерименту входить:
|
|
l |
|
s |
|
Δτ |
|
E |
. |
|
l |
s |
τ |
|
|||||
|
|
|
|
E |
|||||
Відстань між електродами l вимірюється з точністю до 0,5 10-3м. Припустимо, що відстань між електродами дорівнює 0,2 м. Тоді
l |
100 % |
0,5 10 3 |
100 % 0,25 % . |
|
l |
0,2 |
|||
|
|
Шлях s, пройдений межею поділу золь гідроксиду заліза – бокова рідина (приймемо таким, що дорівнює 0,015 м), виміряний з точністю 0,5 10-3 м. Похибка
s 100 % 0,5 10 3 100 % 3,6 % . s 0,015
71

Час , протягом якого проводився експеримент, вимірюється за допомогою секундоміра з точністю до 1 с і дорівнює 360 с. Тоді:
Δττ 100 % 3601 100 % 0,28 % .
Похибка вимірювання напруги за допомогою вольтметра становить 2 % (за класом точності вольтметра).
Отже, загальна похибка у визначенні -потенціалу дорівнюватиме 6,13 %.
Питання для самоперевірки
1.Наведіть можливі причини виникнення подвійного електричного шару ПЕШ на міжфазних поверхнях? Наведіть приклади.
2.Дайте характеристику будови ПЕШ на прикладі міцели золю гідроксиду заліза. Як змінюється потенціал зі зміною відстані від поверхні?
3.Які електрокінетичні явища Ви знаєте? Чим вони зумовлені?
4.Що називається міжфазним та електрокінетичним ( -потенціалом) потенціалами? Яка між ними відмінність?
5.Які фактори впливають на -потенціал?
6.Які методи визначення електрокінетичного потенціалу Ви знаєте?
7.Напишіть рівняння Гельмгольца – Смолуховського для визначення - потенціалу. Проаналізуйте його.
8.Які властивості повинна мати бокова рідина?
9.За величиною якого потенціалу судять про стійкість колоїдного розчину?
10.Як визначається заряд колоїдної частинки гідрозолю?
Лабораторна робота № 11
ВИЗНАЧЕННЯ ПОРОГУ КОАГУЛЯЦІЇ ЗОЛЮ ГІДРОКСИДУ ЗАЛІЗА ТА ПЕРЕВІРКА ПРАВИЛА ШУЛЬЦЕ-ГАРДІ
Мета роботи – визначити залежність порогу коагуляції золю гідроксиду заліза від заряду іона-коагулятора та перевірити правило Шульце-Гарді.
Теоретичні відомості
Під стійкістю дисперсних систем розуміють сталість у часі її стану та основних властивостей: дисперсності, рівномірного розподілення частинок дисперсної фази у об’ємі дисперсійного середовища, збереження характеру взаємодії між частинками тощо. Особливо важливою є стійкість ліофобних колоїдів, оскільки вони термодинамічно нестабільні і здатні до коагуляції.
Седиментаційна стійкість – це здатність системи зберігати рівномірне розподілення частинок в об’ємі дисперсійного середовища. Основними умовами цієї стійкості є висока дисперсність та участь частинок дисперсної фази в броунівському русі.
72

Агрегативна стійкість – це здатність системи зберігати свою ступінь дисперсності, тобто не змінювати розміри частинок під впливом зовнішніх факторів. За цими ознаками системи поділяються на два класи:
1)термодинамічно стійкі (ліофільні) системи, які самочинно диспергуються та існують без додаткової стабілізації. Сюди відносяться міцелярні розчини ПАР та розчини ВМС. При утворенні таких систем вільна енергія Гіббса зменшується, тобто ∆G < 0;
2)термодинамічно нестійкі (ліофобні) системи. Сюди відносяться золі, суспензії та емульсії, тобто системи, у яких слабка взаємодія між частинками дисперсної фази та дисперсійним середовищем. При утворенні таких систем виникає велика поверхня розділу фаз. Вони мають значний надлишок вільної поверхневої енергії, тобто ∆G > 0. Такі системи термодинамічно нестійкі. В них відбуваються самочинно процеси, що призводять до зменшення поверхневої енергії за рахунок збільшення розмірів колоїдних частинок внаслідок їх злипання та подальшої коагуляції.
Коагуляцією називається процес злипання частинок дисперсної фази під дією міжмолекулярних сил притягування. Коагуляцію золю може викликати будь-який фактор, що порушує агрегативну стійкість системи, але найважливішим фактором є дія електролітів. Відповідно з теорією ДЛФО введений електроліт у дисперсну систему спричиняє стиснення ПЕШ, а отже і зменшення ζ–потенціалу, який відповідає за її стійкість. Коагуляція золів може відбутися і внаслідок дії фізичних факторів.
Відповідно до теорії ДЛФО, введення електроліту в дисперсну систему спричиняє стиснення ПЕШ на поверхні частинок, внаслідок чого вони можуть зблизитися до відстані, на якій переважають сили притягування. Зменшення товщини ПЕШ супроводжується обміном протиіонів дифузного шару на іони електроліту, які спричиняють коагуляцію. Стиснення ПЕШ відбувається як за рахунок зменшення електричного потенціалу внаслідок специфічної адсорбції іонів введеного електроліту, так і через обмеження дифузії протиіонів у розчин
узв’язку зі збільшенням іонної сили розчину.
Згідно з правилом Шульце – Гарді коагулююча дія властива тому іону електроліту, що має заряд, протилежний заряду колоїдної частинки; коагулююча дія тим сильніша, чим вищий заряд іона-коагулятора. Оскільки колоїдна частинка золю гідроксиду заліза заряджена позитивно, то коагулюючу дію матимуть аніони електролітів, введених у даний золь.
Критичне мінімальне значення концентрації введеного у золь електроліту, за якої даний електроліт спричиняє коагуляцію даного золю, називають порогом коагуляції. Поріг коагуляції розраховують за рівнянням
C K |
C 10 3 |
, |
(11.1) |
1 n 3 |
де С – концентрація електроліту, моль/л ; n – кількість мілілітрів дистильованої води, взятих для розведення.
Коагулююча дія – це величина, обернено пропорційна порогу коагуляції:
73

V |
1 |
. |
(11.2) |
|
|||
|
CK |
|
|
Коагулююча дія виражається числом об’ємів золю, скоагульованих одним молем іона-коагулятора.
Завдання на виконання роботи
1.Провести коагуляцію золю гідроксиду заліза електролітами: 3 М KCl, 0,05 M K2SO4 , 0,001 M K3[Fe(CN)6].
2.Розрахувати для них пороги коагуляції.
3.Розрахувати коагулюючу здатність для даних електролітів.
4.Порівняння коагулюючої дії різних електролітів.
Прилади, лабораторний посуд та реактиви
Три штативи – кожний з 18 пробірками, колби для великих розведень (розведення більші, ніж 1:10), бюретка місткістю 25 мл, градуйовані піпетки місткістю 10 і 2 мл, золь гідроксиду заліза, електроліти: 3 M KСl, 0,05 M K2SO4, 0,001 M K3[Fe(CN)6].
Порядок виконання роботи
1. Приготувати розчини різних розведень електролітів відповідно до табл.11.1.
Таблиця 11.1
Результати дослідження коагуляції золю гідроксиду заліза
|
Концент |
|
|
|
|
Серія розведення |
|
|
||
Електроліт |
-рація С, |
|
|
|
|
|
|
|
|
|
|
|
перша |
|
|
друга |
|||||
|
моль/л |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
KCl |
3,0 |
|
1:0; |
1:1; |
1:2; |
1:3; |
1:5 |
1:0,2; 1:0,5; 1:0,8 |
||
|
|
|
+ |
– |
– |
– |
– |
+ |
+ |
– |
K2SO4 |
0,05 |
1:0; 1:1; 1:5; 1:10; 1:20; 1:30 |
1:12; 1:14; 1:17 |
|||||||
|
|
+ |
+ |
+ |
+ |
– |
– |
+ |
+ |
– |
K3[Fe(CN)6] |
0,001 |
1:0; 1:1; 1:5; 1:10; 1:20; 1:30 |
1:2; |
1:3; |
1:4 |
|||||
|
|
+ |
+ |
– |
– |
– |
– |
+ |
– |
– |
Для виключення впливу катіонів користуються калійними солями.
2.Від кожного розведення відібрати по 2 мл у чисті пробірки і долити у них по 4 мл золю гідроксиду заліза.
3.Через 20 хв позначити пробірки, в яких сталася коагуляція золю (тобто виникло помутніння). Розведення електролітів, що спричинили коагуляцію золю, позначити плюсом, а де не відбулася коагуляція – мінусом
(див. табл.11.1).
74

4.Провести аналогічні дії для другої серії розведень. Розведення готують таким чином, щоб концентрації розчинів коагулюючого електроліту знаходились між двох сусідніх значень концентрації першої серії розбавлень, одна з яких викликала коагуляцію, а друга була нижче порогу коагуляції.
5.Виходячи з одержаних даних, розрахувати поріг коагуляції кожного електроліту за даними останньої пробірки, в якій пройшла коагуляція за найменшої концентрації розчину, використовуючи рівняння (11.1).
6.Розрахувати коагулюючу дію для кожного електроліту за рівнянням
(11.2).
7.Перевірити правило Шульце – Гарді, використовуючи рівняння (11.3).
Опрацювання результатів
Одержані розрахункові дані заносяться до табл. 11.2
Таблиця 11.2
Результати визначення порогу коагуляції та коагулюючої дії іонів різної валентності
Дані |
|
Іони-коагулятори |
|
Cl– |
SO42– |
[Fe(CN)6]3– |
|
Валентність іонів |
1 |
2 |
3 |
|
|
|
|
Поріг коагуляції |
|
|
|
Коагулююча дія іонів |
|
|
|
Отже, чим більша валентність іона-коагулятора, то більше число об’ємів золю можна скоагулювати одним його молем. Для того, щоб визначити у скільки разів збільшується коагулююча дія зі збільшенням валентності іонакоагулятора, слід коагулюючу дію двозарядного іона розділити на коагулюючу дію однозарядного, а коагулюючу дію тризарядного – на коагулюючу дію однозарядного, тобто:
VII x1 |
; |
VIII x2 |
(11.3) |
VI |
|
VI |
|
Оцінка похибки вимірювань
Загальна похибка проведення експерименту
|
|
|
CK |
|
|
V1 |
|
V2 |
|
V3 |
. |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
C |
K |
V |
V |
V |
|||||
|
|
|
|
|
1 |
|
2 |
|
3 |
|
||
При розведенні електролітів використовують градуйовану піпетку |
||||||||||||
місткістю 10 мл. Похибка |
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
100 % |
0,05 |
100 % 0,5 % . |
|||||||
|
V |
|
10 |
|||||||||
1
При відбиранні 2 мл від кожного розведення використовують градуйовану піпетку місткістю 2 мл. Тоді похибка
75

V2 |
100 % |
0,03 |
100 % 1,5 % . |
|
V2 |
2 |
|||
|
|
Похибка під час наливання у пробірки золю по 4 мл за допомогою бюретки місткістю 25 мл
V3 100 % 0,05 100 % 0,2 % . V3 25
Отже, загальну похибку проведення експерименту можна прийняти такою, що дорівнює 2,2 %.
Питання для самоперевірки
1.Наведіть види стійкості дисперсних систем відповідно до класифікації Пєскова? У чому полягають відмінності між ліофільними та ліофобними колоїдними системами?
2.Чим зумовлена агрегативна нестійкість ліофобних дисперсних систем? Які процеси мимовільно проходять у цих системах?
3.Який процес називають коагуляцією? Чим вона завершується? Якими способами можна викликати коагуляцію ліофобної системи?
4.У чому полягає суть теорії стійкості колоїдних систем ДЛФО? Накресліть потенціальні криві взаємодії колоїдних частинок.
5.Що називається порогом коагуляції? Як впливає заряд іонакоагулятора на поріг коагуляції?
6.Що називають коагулюючою дією? Який її фізичний зміст?
7.Які іони введеного у золь електроліту спричиняють його коагуляцію?
8.Сформулюйте правило Шульце – Гарді.
Лабораторна робота № 12
ВИВЧЕННЯ КІНЕТИКИ ТА ВИЗНАЧЕННЯ СТУПЕНЯ НАБУХАННЯ ЖЕЛАТИНИ
Мета роботи – навчитися визначати швидкість та ступінь набухання полярних та неполярних високомолекулярних сполук в різних розчинниках.
Теоретичні відомості
Високомолекулярні сполуки (ВМС) отримали свою назву завдяки великій величині їхньої молекулярної маси, яка відрізняє їх від низькомолекулярних сполук (НМС). До високомолекулярних сполук прийнято відносити речовини з молекулярною масою не менше 5000. Таку велику молекулярну масу можуть мати тільки хімічні речовини, молекули яких складаються з багатьох сотень атомів. Молекули ВМС внаслідок великих розмірів та мас називають
макромолекулами.
Всі макромолекули ВМС незалежно від будови мономерної ланки мають ланцюгову будову. У процесі синтезу лінійне розташування у ланцюгу може
76
порушуватися, можуть утворюватися просторові або зшиті структури макромолекул. Так, природний каучук має лінійне розташування ланок у ланцюгу, крохмаль – розгалужене, а вулканізований каучук (гума) є типовим прикладом зшитої структури.
Розчини ВМС мають властивості як істинних, так і колоїдних розчинів, а також проявляють специфічні властивості, що притаманні тільки ВМС, наприклад, набухання та драглеутворення.
ВМС у споріднених розчинниках утворюють молекулярні (істинні) розчини. Розчини ВМС утворюються самодовільно зі зменшенням вільної енергії і тому вони термодинамічно стійкі. Стійкість розчину ВМС визначається тим, що зв’язок між макромолекулами слабший, ніж зв’язок між макромолекулами і молекулами розчинника. Тому сухий залишок ВМС при додаванні до нього розчинника переходить у розчин. Розчини ВМС можуть бути як молекулярними, так і іонними. В усіх випадках вони є гомогенними системами. Всі перераховані ознаки характерні для істинних розчинів.
Розчини ВМС мають і деякі властивості ліофобних колоїдних розчинів, оскільки розміри макромолекул ВМС відповідають розмірам частинок високодисперсних систем – 10-7÷10-9м. Макромолекули ВМС не проходять крізь напівпроникні мембрани. Макромолекули розчинів ВМС подібно частинкам колоїдних розчинів здатні до броунівського руху і дифузії, а також до розсіювання світла. Для розчинів ВМС характерні осмос, зворотний осмос і ультрафільтрація. Макромолекули ВМС в рідкому середовищі можуть утворювати суспензії, емульсії, піни. Для них характерні такі поверхневі явища, як адсорбція та адгезія.
ВМС розчиняються лише у тих розчинниках, до яких вони ліофільні: гідрофільні полімери розчиняються у воді та інших полярних розчинниках, а олеофільні – у неполярних вуглеводневих. Наприклад, желатин при нагріванні розчиняється у воді і утворює істинний розчин, тому що до його складу входять полярні групи –СООН і –NH2, які мають спорідненість до води. Якщо воду замінити на спирт, тоді істинний розчин желатину переходить у колоїдний і утворюється гель. Каучук розчинний у бензолі, бензині та інших вуглеводнях, але не розчинний у воді і утворює у водному середовищі колоїдні розчини, які називають латексами.
Розчини ВМС мають і специфічні властивості: їм притаманна висока в’язкість і здатність до набухання і драглеутворення.
Процес розчинення високомолекулярних сполук проходить у дві стадії. Перша стадія – це набухання ВМС, а друга – безпосередньо розчинення. Набухання – це мимовільний процес поглинання молекул розчинника (НМС) молекулами ВМС, що супроводжується значним збільшенням об’єму та маси полімеру. Воно характеризується ступенем набухання α:
|
m m |
|
mp |
|
|
0 |
|
(12.1) |
|||
m0 |
|||||
|
m0 |
|
|
де m0, m – маси наважки ВМС до і після набухання; mp – маса поглиненої рідини.
77

Ступінь набухання – це кількість рідини, що поглинається одиницею маси ВМС. Ступінь набухання змінюється в широких межах і для природних ВМС може досягати 1600%.
Причиною набухання є різниця властивостей двох компонентів ВМС і НМС ( розчинника), тобто низькомолекулярної сполуки. Специфіка набухання полягає в тому, що взаємодіють і змішуються молекули різного розміру і вони, відповідно, мають різні швидкості дифузії. Тому перехід макромолекул в фазу розчинника відбувається дуже повільно, тоді як молекули НМС дуже рухливі, вони швидко дифундують в сітку полімеру, розсувають ланцюги і збільшують його об’єм.
Здатність до набухання – це специфічна властивість високомолекулярних сполук, яка залежить від їхнього складу та будови і визначається сольватацією макромолекул. Тому набухання завжди супроводжується виділенням теплоти ( 0 ) і збільшенням об’єму полімеру, а об’єм усієї системи (полімер + розчинник) зменшується. Зменшення об’єму системи (її стиснення) в цілому при набуханні називається контракцією.
Процес набухання може бути обмеженим або необмеженим. Набухання називається обмеженим, якщо в надлишку розчинника ВМС набухає до певної межі і цей процес закінчується утворенням драглів, а не розчиненням ВМС. Прикладом обмеженого набухання є набухання желатину у холодній воді. Обмежено набухлий полімер називається драглі.
Набухання вважається необмеженим, якщо в надлишку розчинника драглі полімеру мимовільно переходять в розчин із зростанням ентропії системи. Прикладом необмеженого набухання є желатин у гарячій воді.
Для одного й того ж ВМС і розчинника можна одночасно спостерігати обмежене і необмежене набухання. Наприклад, 10÷20 % крохмалю у гарячій воді розчиняється, а решта – обмежено набухає. Цей процес залежить від будови макромолекул крохмалю, кількості його складових частин (амілози та амілопектину
Процес набухання описується кінетичним рівнянням першого порядку:
dα |
K(α α) |
(12.2) |
|
dτ |
|||
|
|
де ddατ – швидкість набухання на момент часу ; α – ступінь набухання в момент
часу , α∞ – граничний (максимальний) ступінь набухання; К – константа швидкості набухання.
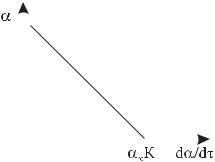
Величини граничного ступеня набухання α∞ та константи швидкості набухання К можна визначити графічно. Для цього експериментально визначають залежність ступеня набухання від часу, розраховують швидкість
набухання в певні моменти часу та будують пряму в координатах α f( ddατ )
(рис. 9.1). Відрізок, що відсікає пряма на осі ординат, дорівнює α∞ , а на осі абсцис – К α∞.
78
|
|
|
Набухання |
протікає |
в |
чотири |
|
|
|
|
стадії. На першій стадії відбувається |
||||
|
|
|
|||||
|
|
|
сольватація (гідратація) ВМС. При |
||||
|
|
|
цьому |
виділяється |
|
теплота |
|
|
|
|
ΔΗ 0, |
S 0 i |
G 0 . |
На |
другій |
|
|
|
стадії |
молекули |
розчинника |
||
|
|
|
дифундують у макромолекули ВМС, |
||||
|
|
|
полярні |
молекули |
розчинника |
||
|
|
|
|||||
|
|
|
утворюють сольватний (гідратний) |
||||
Рис. 9.1. Залежність ступеня |
шар, відбувається відштовхування |
||||||
набухання від швидкості набухання |
однойменних |
зарядів |
сольватних |
||||
полімеру |
оболонок і слабкі зв’язки між |
||||||
макромолекулами рвуться. |
|
||||||
|
|
|
|
||||
На третій стадії спостерігається взаємне проникнення молекул ВМС і НМС. Об’єм набухлого полімеру стає ще більший. На цій стадії теплота сольватації майже не виділяється ( 0 ), але зростає ентропія, що пов’язано з частковим вивільненням макромолекул і збільшенням числа їх конформаційS 0 , G S 0 . Таким чином, третя стадія набухання обумовлена ентропійним ефектом. На четвертій стадії утворюється гомогенна система – розчин. Якщо процес набухання протікає в чотири стадії, то має місце необмежене набухання. Якщо ж процес обмежується другою або третьою стадією набухання – це обмежене набухання, утворюються драглі.
На ступінь набухання та розчинення ВМС впливають різні фактори. В першу чергу, це природа полімеру і розчинника. Полярні полімери добре розчиняються у полярних розчинниках, а неполярні – в неполярних органічних рідинах.
З підвищенням в’язкості розчинника швидкість його дифузії в макромолекули ВМС зменшується, що викликає сповільнення процесу набухання.
Температура і тиск впливають на набухання (розчинення) за принципом Ле Шательє. Оскільки набухання відбувається з виділенням теплоти, то з підвищенням температури ступінь набухання зменшується, але швидкість набухання зростає завдяки збільшенню швидкості дифузії.
При збільшенні молекулярної маси полімеру процеси набухання протікають повільніше, а розчинність зменшується.
Набухання поліелектролітів у воді залежить від рН середовища. Біологічні молекули, такі як амінокислоти та білки, за своєю природою є амфотерними, оскільки містять як кислотні так і основні функціональні групи. Заряд різних функціональних груп таких сполук може змінюватись в результаті зв’язування чи, навпаки, втрати протонів H+. Ступінь іонізації амінокислот та білків залежить від рН середовища.
Амінокислоти у водних розчинах знаходяться у формі біполярних іонів:
79

COOH |
|
COO- |
||||
|
|
|
R |
|
N+H3 |
|
R NH2 |
|
|||||
|
||||||
У кислому середовищі при надлишку іонів Н+ відбувається протонування карбоксильної групи, молекула амінокислоти виявляє основні властивості і набуває позитивного заряду. Під впливом однойменних позитивних зарядів і електростатичного відштовхування відбувається розтягування ланцюгів білка. У таких випадках гідратація супроводжується набуханням желатину.
- |
|
|
COOH |
||||
COO |
H |
+ |
|||||
|
|
|
|
|
|
||
R |
|
N+H3 |
|
R |
|
N+H3 |
|
|
|
|
|
||||
|
|
|
|
||||
В лужному середовищі протікає депротонування аміногрупи, молекула при цьому набуває від’ємного заряду.
COO- OH- COO-
R N+H3 R
N+H3 R NH2
NH2
Кислотність середовища (pH), при якій амфотерна молекула містить однакову кількість іонізованих основних і кислотних груп називається ізоелектричною точкою (рІ). В ізоелектричній точці сумарний заряд молекули дорівнює 0. Внаслідок електростатичного притягування різнойменно заряджених груп макромолекули згортаються в щільний клубок. При цьому ступінь набухання білка мінімальний. При збільшенні або зменшенні рН від ізоелектричної точки однойменно заряджені групи відштовхуються, макромолекули розгортаються і набухання збільшується.
Таким чином, заряд білка буде залежать від рН середовища і від співвідношення іонізованих карбоксильних і амінних груп у макромолекулі.
Значення рН ізоелектричної точки для деяких білків складає: казеїн – 4,6; желатин – 4,7; яєчний альбумін – 4,8; глобулін – 5,4; гліадін пшениці – 9,8.
При введенні електролітів в розчини ВМС спостерігається процес висолювання. При висолюванні відбувається боротьба за воду між макромолекулами та іонами. Іони електроліту зменшують кількість вільної води, що припадає на макромолекули ВМС. Це викликає виділення ВМС з розчину, тобто драглеутворення.
Висолювання із водних розчинів ВМС може відбуватися і при додаванні спирту, ацетону та інших органічних розчинників. Ці речовини з водою гідролізуються. Вони руйнують гідратну оболонку, знижують розчинність ВМС, що приводить до утворення осаду. Це явище використовують для виділення із водних розчинів білків, а часто і для розділення їх на фракції. Для цього спирт добавляють порціями, спочатку випадають білки з великою
80
