
- •ЛАБОРАТОРНИЙ ПРАКТИКУМ
- •Рецензент Пирог Т.П., д-р біол. наук
- •І.В. ЛИЧ, канд. біол. наук,
- •Рецепти приготування реактивів, барвників, поживних середовищ
- •1. Ознайомитись з правилами роботи і техніки безпеки в технологічній лабораторії.
- •Контрольні запитання
- •Загальні відомості
- •На сьогодні екстракційні препарати з лікарської сировини за технологією одержання можна поділити на 3 групи:
- •Настоянки. Екстракти.
- •Завдання на виконання
- •Контрольні запитання
- •Контрольні запитання
- •Лабораторна робота № 7
- •7.1. Фосфатний буферний розчин (рН 7,0) стерильний:
- •ЛІТЕРАТУРА
- •ПРОМИСЛОВА ТЕХНОЛОГІЯ
- •ЛІКАРСЬКИХ ЗАСОБІВ
стерильності вносять у пробірку з 10 мл стерильного фосфатного буферу (рН = 7,0), добре перемішують.
3.Визначення загальної кількості бактерій та загальної кількості грибів.
Учашки Петрі діаметром 9 см вносять від 15 мл до 20 мл розплавленого густого живильного середовища для вирощування бактерій (МПА) або розплавленого густого живильного середовища для вирощування грибів(агар Сабуро) із температурою від 45°С до 50°С і дають середовищу застигнути. 1 мл зразка, підготованого, як описано в розділі «Підготовка зразка», вносять у пробірку стерильною піпеткою, що містить близько 4 мл розплавленого і охолодженого до температури не більше 45°С густого живильного середовища МПА або густого живильного середовища Сабуро. Швидко перемішують вміст пробірки і переносять у чашку Петрі, підготовану, як описано вище, що містить густе живильне середовище МПА або Сабуро, відповідно. Швидким погойдуванням чашки Петрі рівномірно розподіляють верхній шар поживного середовища. Для кожного розведення використовують не менше двох чашок Петрі з кожним поживним середовищем. Після застигання середовища чашки перевертають й інкубують при температурі від 30°С до 35°С (від 20°С до 25°С для грибів) протягом п’яти діб, якщо вірогідні результати випробування не будуть одержані за коротший час. Обчислюють середнє арифметичне значення числа колоній і визначають число колонієутворюючих одиниць у грамі або мілілітрі.
4.Визначення бактерій родини Enterobacteriacea (E. coli, Salmonella):
Відповідно 1 мл зразку лікарського засобу вносять у10 мл поживного се-
редовища №3 і інкубують при температурі від35°С до 37°С від 18 до 48 год. Якщо у середовищі з’явилися ознаки бродіння, помутніння середовища, то петлею роблять пересів на середовище №4 (Ендо) для ідентифікації E. coli та №5 (ВСА) для Salmonella і інкубують при температурі від 35°С до 37°С від 18 до 48 год. Проводять кількісний підрахунок колоній, визначають середньоарифметичну кількість мікроорганізмів, мікроскопіюють окремі колонії.
5. Визначення бактерій S.aureus та P.aeruginosa:
Відповідно 1 мл зразку лікарського засобу вносять у10 мл поживного середовища №8 і інкубують при температурі від35°С до 37°С від 24 до 48 год. Після закінчення періоду інкубації, при появі мутності роблять пересівання петлею на чашку з густим поживним середовищем10 №для ідентифікації S.aureus та №9 для P.aeruginosa і інкубують при температурі від35°С до 37°С від 24 до 48 год. Проводять кількісний підрахунок колоній, визначають середньоарифметичну кількість мікроорганізмів, мікроскопіюють окремі колонії.
6.Вивчити методику визначення антимікробної дії лікарських засобів.
7.Записати склад 15 поживних середовищ, які використовують в фармацевтичній промисловості
8.Оформити протокол заняття, зробити висновки до лабораторної роботи.
Контрольні запитання
1.Дайте визначення поняттям«мікробіологічна чистота» та «стерильність» лікарських засобів.
2.Яким чином проводять визначення стерильності лікарських засобів?
84
3.Які етапи включає дослідження на мікробіологічну чистоту лікарських засобів?
4.Як проводять кількісне визначення мікроорганізмів у досліджуваних зразках?
5.Які методи кількісного обліку мікроорганізмів Вам відомі?
6.Які поживні середовища використовують для аналізу лікарських засобів
на стерильність та мікробіологічну чистоту?
7. Які селективні середовища використовують для виявлення умовнопатогенних мікроорганізмів у лікарських препаратах?
85
Лабораторна робота № 8
МЕТОДИ МІКРОБІОЛОГІЧНОГО КОНТРОЛЮ ЛІКАРСЬКИХ ЗАСОБІВ (закінчення). (4 год)
Мета роботи: ознайомлення з методами контролю лікарських засобів на стерильність та мікробіологічну чистоту (закінчення).
Матеріали та обладнання: спиртівки, бактеріологічні петлі, препарувальні голки, предметні та накривні скельця, фільтрувальний папір, промивалки з дистильованою водою, мікроскопи.
Загальні відомості Облік і інтерпретація результатів щодо визначення стерильностілі
карських засобів.
Посіви переглядають періодично під час і після закінчення інкубаційного періоду, відмічаючи наявність візуально виявлюваного росту мікроорганізмів. Якщо випробовуваний зразок викликає помутніння живильного середовища, що робить неможливим візуальний облік, то через 14 діб після початку інкубації з кожної посудини переносять певну кількість середовища в посудини з тим самим свіжим живильним середовищем. Продовжують інкубацію вихідних і повторних посівів. Загальний час інкубації має становити не менш як (14+7) діб від початку випробування.
Лікарський засіб витримує випробування на стерильність, якщо при візуальному обліку не виявляється ріст мікроорганізмів. При наявності росту мікроорганізмів вважають, що лікарський засіб не витримує випробування на стерильність, якщо не доведена невірогідність результатів випробування, викликана причинами, не пов’язаними з випробовуваним лікарським засобом. Результати випробування можуть бути визнані невірогідними, якщо виконується одна або кілька з умов, наведених нижче:
a)одержані незадовільні результати мікробіологічного контролю навколишнього середовища в ході проведення випробування на стерильність;
b)виявлені помилки, допущені в ході випробування;
c)виявлений ріст мікроорганізмів у негативному контролі;
d)після ідентифікації мікроорганізмів, виділених з лікарського засобу, однозначно визнано, що при чиною виникнення росту цього виду або видів є матеріали і/або технічні прийоми, використані при випробуванні на стерильність.
Якщо результати випробування визнані невірогідними, його повторюють на тій самій кількості зразків, що й початкове.
Якщо в результаті повторного випробування не було виявлено росту мікроорганізмів, вважають, що лікарський засіб витримує випробування на стерильність. Якщо в результаті повторного випробування було виявлено ріст мікроорганізмів, лікарський засіб не витримує випробування на стерильність.
Облік і інтерпретація результатів щодо визначення мікробіологічної чистоти лікарських засобів.
86
Загальне число бактерій визначають, виходячи із середнього значення числа колонієутворюючих одиниць, які виросли на густому живильному середовищі МПА. Загальне число грибів визначають, виходячи із середнього значення числа колонієутворюючих одиниць, вирощених на густому живильному середовищі Сабуро. Загальне число життєздатних аеробних мікроорганізмів знаходять як суму загального числа бактерій і загального числа грибів, визначених, як описано вище. Якщо установлено, що на живильному середовищі для вирощування бактерій і живильному середовищі для вирощування грибів спостерігається ріст одних і тих самих мікроорганізмів, необхідно внести відповідні поправки. При використанні методу найбільш імовірного числа визначають загальне число бактерій.
Якщо допустимі межі вмісту мікроорганізмів визначені в окремій статті, результати інтерпретують так:
102 мікроорганізмів – максимально допустима межа: 5×102; 103 мікроорганізмів – максимально допустима межа: 5×103.
Вимоги щодо стерильності та мікробіологічної чистоти лікарських за-
собів. При виробництві, пакуванні, зберіганні i розповсюдженні готових лікарських засобів мають бути вжиті відповідні заходи для забезпечення їх мікробіологічної чистоти та стерильності. До готових лікарських засобів рекомендується ставити вимоги, наведені нижче.
КАТЕГОРІЯ 1
Готові лікарські засоби, до яких ставляться вимоги щодо стерильность у відповіднux загальних статтях на лікарські форми та інші готові лікарські засоби, марковані як стерильні.
· Мають витримувати випробування на стерильність (2.6.1). КАТЕГОРІЯ 2
Готові лікарські засоби для місцевого застосування і застосування у pecnipaторному тракті, за винятком тих, до яких ставляться вимоги щодо стерильності, i трансдермальні nлacmupi.
·Загальне число життєздатних аеробних мікроорганізмів(2.6.12): не більше 102 мікроорганізмів (аеробних бактерій i грибів сумарно) у грамі, мілілітрі або на один пластир (включаючи клейкий шар i основу).
·Трансдермальні пластирі: відсутність ентеробактерій i деяких інших
грамнегативних бактерій на |
одному |
пластирі(включаючи клейкий шарi |
основу). Іншi готові лікарські |
засоби: не |
більше 101 ентеробактерій i деяких |
інших грамнегативних бактерій у грамі або мілілітрі (2.6.13).
·Відсутніть Pseudomonas aeruginosa в 1г, 1 мл або на одному пластирi (включаючи клейкий шар i основу) (2.6.13).
·Відсутність Staphylococcus aureus в 1г, 1 мл або на одному пластирі (включаючи клейкий шар i основу) (2 6.13).
КАТЕГОР1Я 3
A. Готові лікарські засоби для орального застосуванняi ректального введення.
·Загальне число життєздатних аеробних мікроорганізмів(2.6.12): не
87
більше 103 бактерій i не більше 102 грибів у гpaмi або мілілітрі.
· Відсутність Escherichia coli в 1г або 1 мл (2.6.13).
B. Готові лікарські засоби для орального застосування, до складу яких входять субстанції i допоміжні речовини природнього (тваринного, рослинного або мінерального) походження, для яких попередня антимікробна обробка неможлива і щодо яких компетентний уповноважений орган допускає мікробне забруднення більше 103 життєздатних мікроорганізмів у грамі або мілілimpi.
За винятком рослинних лікарських засобів, що належать до категорії 4.
·Загальне число життєздатних аеробних мікроорганізмів(2.6.12): не більше 104 бактерій i не більше102 грибів у грамi або мілілітpi.
·Не більше 102 ентеробактерій i деяких інших грамнегативних бактерій у гpaмi або мілілітрі (2.6.13).
·Відсутність Salmonella у 10 г або 10 мл (2.6.13).
·Відсутність Escherichia coli в 1г або 1 мл (2.6.13).
·Відсутність Staphylococcus aureus в 1г або 1 мл (2.6.13).
КАТЕГОРІЯ 4
Лікарські засоби, що складаються тільки з рослинних компонентів, одного або кількох (цілісних, здрібнених, розтертих на порошок).
A. Рослинні лікарські засоби, до яких перед вживанням додають киплячу воду.
· Загальне число життєздатних аеробних мікроорганізмів(2.6.12): не більше 107 бактерій i не більше 105 грибів у грамi або мілілітрі.
· Не більше 102 Escherichia coli у грамi або мілілітрі (2.6.13), із використанням підхожих розведень.
B. Рослинні лікарські засоби, до яких перед вживанням не додають киплячу воду.
·Загальне число життєздатних аеробних мікроорганізмів(2.6.12): не більше 105 бактерій i не більше 104 грибів у грамi або мілілітрі.
·Не більше 103 ентеробактерій i деяких інших грамнегативних бактерій у грамi або мілілітрі (2.6.13).
·Відсутність Escherichia coli в 1г або 1 мл (2.6.13).
·Відсутність Salmonella у 10г або 10 мл (2.6.13).
У тому випадку, коли виробництво лікарського засобу не проводиться відповідно до вимог належної виробничої практики(НВП, GMP), встановлених
у Європейському Cniвmoвapucmвi, до даного лікарського засобу мають ставитися такі вимоги щодо мікробіологічної чистоти.
КАТЕГОРІЯ 1
Готові лікарські засоби, до яких ставляться вимоги щодо стерильності відповіднo до загальних статей на лікарські форми (парентеральні: для ін'єкцій, інфузій та .;ін офтальмологічні; для введения у порожни ,тіладе в нормальному стані відсутні мікроорганізми), й інші готові лікарські засоби, марковані як стерильні.
· Мають витримувати випробування на стерильність (2.6.1).
88
КАТЕГОРІЯ 2 |
|
|
|
|
Готовi |
лікарські |
засоби |
для |
, місцевоготрансдермального, |
інтравагінального застосування; для |
введения у |
порожнини вуха, носа i |
||
застосування у ротовій порожнині; гomoвi лікарські засоби для інгаляції; за винятком тих, до яких ставляться вимоги щодо стерильності.
· Загальне число життєздатних аеробних мікроорганізмів(2.6.12): не більше 102 мікроорганізмів (бактерій i грибів сумарно) у грамi, у мілілітрi або на один пластир (включаючи клейкий шар i основу).
· Відсутність ентеробактерій i деяких інших грамнегативних бактерій в 1г, 1 мл або на одному пластирі (включаючи клейкий шар i основу) (2.6.13).
·Відсутність Pseudomonas aeruginosa в 1г, 1 мл або на одному пластиpi (включаючи клейкий шар i основу) (2.6.13).
·Відсутність Staphylococcus aureus в 1г, 1 мл або на одному пластиpi (включаючи клейкий шар i основу) (2.6.13).
КАТЕГОРІЯ 3
A. Готовіi лікарські засоби для орального застосуванняi ректального введення.
·Загальне число життєздатних аеробних мікроорганізмів(2.6.12): не більше 103 бактерій i не більше 102 грибів у грамі або мілілітрі.
·Відсутність бактерій род. Enterobacteriaceae в 1г або 1 мл (2.6:13).
·Відсутність Pseudomonas aeruginosa в 1г або 1 мл (2.6.13).
·Відсутність Staphylococcus aureus в 1г або 1 мл (2.6:13).
В. Готові лікарські засоби для орального застосування, до складу яких входить сировина природнього(тваринного, рослинного або мінерального) походження, для якої попередня антимікробна обробка неможлива, i щодо
яких компетентний |
уповноважений орган допускає мікробне забруднення |
сировини биьше 103 |
життєздатних мікроорганізмів у грамі або мілілітрі. За |
винятком рослинних лікарських засобів, що належать до категорії 4.
·Загальне число життєздатних аеробних poopмік ганізмів (2.6.12): не більше 104 бактерій i не більше 102 грибів у грамi або мілілітрі.
·Не більше 102 ентеробактерій i деяких інших грамнегативних бактерій у грамi або мілілітрі (2.6.13).
·Відсутність Salmonella у 10г або 10 мл (2.6.13).
·Відсутність Escherichia coli в 1г або 1 мл (2.6.13).
·Відсутність Staphylococcus aureus в 1г або 1 мл (2.6.13).
·Відсутність Pseudomonas aeruginosa в 1г або 1 мл (2.6.13).
КАТЕГОРІЯ 4
Лікарські засоби, що складаються лише з рослинних компонентов, одного або декількох (цілісних, здрібнених, розтертих на порошок), рослинні збори.
A. Рослинні лікарські засоби, до яких перед вживанням додають киплячу воду.
·Загальне число життєздатних аеробних poopмік ганізмів (2.6.12): не більше 107 бактерій i не більше105 грибів у грамi або мілілітрі.
·Не більше 102 Escherichia coli у грамi або мілілітрі (2.6.13).
89
B. Рослинні лікарські засоби, до яких перед вживанням не додають киплячу воду.
·Загальне число життєздатних аеробних мікроорганізмів(2.6.12). Не більше 105 бактерій i не більше 104 грибів у грамi або мілілітрі.
·Не більше 103 ентеробактерій i деяких інших грамнегативних бактерій у грамi або мілілітрі (2.6.13).
·Відсутність Escherichia coli в 1г або 1 мл (2.6.13).
·Відсутність Salmonella у 10 г або 10 мл (2.6.13).
Для того, щоб забезпечити nompi6ny мікробіологічну чистоту готових лікарських засобів, використовувані при xї виробництві субстанції допоміжні речовини мають відповідamu наведеним нижче вимогам щодо мікробіологічної чистоти.
КАТЕГОРІЯ 1
Субстанції і допоміжні речовини для виробництва стерильних готових лікарських засобів, що не піддаються стерилізації.
· Мають витримувати випробування на стерильність (2.6.1). КАТЕГОРІЯ 2
Субстанції i допоміжні речовини для виробництва стерильних готових лікарських засобів, що піддаються стерилізації; готових лікарських засобів для місцевого, трансдермального, інтравагінального застосування, для введения у порожнини вуха, носа i застосування у ротовій порожнині; готових лікарських засобів для інгаляції.
·Загальне число життєздатних аеробних poopмік ганізмів (2.6.12): не більше 102 мікроорганізмів (бактерій i грибів сумарно) у грамi або мілілітрі.
·Відсутність ентеробактерій i деяких інших грамнегативних бактерій в 1г
або 1 мл (2.6.13).
·Відсутність Pseudomonas aeruginosa в 1г або 1 мл (2.6.13).
·Відсутність Staphylococcus aureus в 1г або 1 мот (2.6.13).
КАТЕГОРІЯ 3
А. Субстанції i допоміжні речовини для виробництва готовых лікарських зaco6iв для орального застосування i ректального введення.
·Загальне число життєздатних аеробних мікроорганізмів(2.6.12): не більше 103 бактерій i не більше 102 грибів у грамі або мілілітрі.
·Відсутність бактерій род. Enterobacteriaceae в 1г або 1мл(2.6.13)
·Відсутність Pseudomonas aeruginosa в 1г або 1 мл (2.6.13),
·Відсутність Stapnylocoecus aureus в 1г або 1 мл (2.6.13).
В. Субстанції i допоміжні речовини природного (тваринного, рослинного або мінерального) походження, для яких попередня антимікробна обробка неможлива i щодо яких компетентний уповноважений орган допускає мікробне забруднення більше 103 життєздатних мікроорганізмів у грамi або мілілітрі.
·Загальне число життєздатних аеробних мікроорганізмів(2.6.12): не більше 104 бактерій і не більше102 грибів у грамі або мілілітрі.
·Не більше 102 ентеробактерій i деяких інших грамнегативних бактерій у грамі або мілілітрі (2.6.13).
90

·Відсутність Salmonella у 10 г або 10 мл (2.6.13)
·Відсутність Escherichia coli в 1г або 1 мл (2.6.13).
·Відсутність Staphylococcus aureus в 1г або 1мл(2.6.13).
·Відсутність Pseudomonas aeruginosa в 1 г або 1 мл (2.6.13).
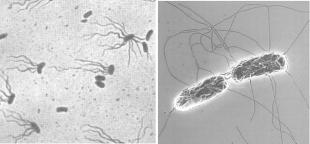
Характеристика окремих патогенних видів мікроорганізмів Рід Staphylococcus.
До складу роду входять більше 20 видів, з яких найбільшого значення ма-
ють S.aureus (золотистий стафілокок), S.epidermidis, S.saprophyticus.
а |
б |
Рис. 8.1. Бактерії Staphylococcus aureus:
у світловому (а) та електронному (б) мікроскопах
Морфологія. Грампозитивні коки, для яких характерне взаєморозташування скупченнями у вигляді виноградних грон, так як вони діляться у взаємноперепендикулярних площинах. Мають мікрокапсулу, спор не утворюють, джгутиків не мають.
Культуральні властивост.і Факультативні анаероби, хемоорганотрофи. Добре ростуть на поживних середовищах, в тому числе на середовищах з5 – 10% NaCl, температурний оптимум від +35 до +37оС, рН 6 – 8 (краще слабколужна реакція середовища). На щільних поживних середовищах утворюють непрозорі округлої форми (2 – 4 мм в діаметрі) колонії, забарвлені в колір ліпохромного пігменту (кремовий, жовтий, жовтогарячий). Крім S-форм колонії можуть утворювати R-форми. На рідких поживних середовищах дають рівномірне помутніння, з наступною появою рихлого осаду.
Біохімічні властивості. Володіють високою біохімічною активністю, утворюють різноманітні ферменти, які в більшості випадків визначають патогенність. Каталаза – позитивні, оксидаза – негативні. Вуглеводи ферментують до кислоти без газу, розжижають желатин з утворенням отворів, утворюють сірководень. За наявністю коагулази їх поділяють на дві групи– коагулазопозитивні (S.aureus) та коагулазонегативні (всі інші).
Основними ознаками патогенності S.aureus є лецитиназна, плазмокоагулазна і гемолітична активність. У харчовій промисловості лецитиназну активність S.aureus виявляють на жовточно-сольовому агарі(середовище Чистовича), потім пересівають колонії на кров’яний агар для перевірки гемолізуючих властивостей і, за необхідності, роблять пересів на бульйон з 1%-им розчином глюкози для перевірки плазмокоагулазної активності.
Фактори патогенності. До них належить мікрокапсула, компоненти клітинної стінки (тейхоєві кислоти, білок А), ферменти та токсини.
1. Факторами адгезії є високі гідрофобні властивості поверхневих струк-
тур.
91
2.Компоненти клітинної стінки стимулюють розвиток запальних реакцій, основне значення мають в них нейтрофіли.
3.Ферменти стафілококів відіграють роль факторів агресії та захисту: головним фактором є плазмокоагулаза, яка сприяє згортанню сироватки (плазми) крові і утворенню тромбіноподібних речовин, які захищають стафілококи і запобігають дії захисних реакцій організму. Крім плазмокоагулази є також інші ферменти: фібролізин, ДНК-аза, лецитиназа і фосфатаза.
4.Стафілококи синтезують великий комплекс екзотоксинів:
·мембранопошкоджуючі токсини можуть порушувати еритроцити(гемолізини), лейкоцити, макрофаги, тромбоцити тощо;
·ексфоліативні токсини викликають дерматонекротичну дію(«пузирчатка новонароджених»);
·екзотоксини викликають синдром токсичного шоку;
·ентеротоксини, з якими пов’язані харчові інтоксикації. Ентеротоксини – термостабільні білки з властивостями суперантигенів. Вони викликають над синтез IL-2, який і обумовлює інтоксикацію. Інтоксикації найчастіше пов’язана зі споживанням інфікованих стафілококами молочних продуктів, яєць та готових продуктів, що містять ці компоненти;
·ряд ентеротоксинів і інших структур стафілококів володіють алергізуючими властивостями;
·фактори, які пригнічують фагоцитоз – капсула, білок А, тейхоєві кислоти, пептидоглікан, токсини.
Особливі властивості збудника.
1.Здатність вражати практично будь-яку тканину та орган.
2.Дуже висока стійкість серед неспороутворюючих бактерій до факторів зовнішнього середовища.
3.Постійне знаходження на покривах шкіри і слизових оболонках.
4.Суперантигенні властивості.
5.Висока мінливість і антибіотикорезистентність.
Виявлення S.aureus у лікарському препараті. Відповідно 1 г або 1 мл лікар-
ського засобу, вносять у 100 мл живильного середовища №8, гомогенізують і інкубують при температурі від 35°С до 37°С від 18 до 24 год. Після закінчення періоду інкубації, при появі мутності роблять пересівання на чашку з густим живильним середовищем №10 і інкубують при температурі від 35°С до 37°С від 24 до 48 год. Ріст золотаво-жовтих колоній, оточених жовтими зонами (що свідчить про ферментацію маніту), вказує на можливість забруднення лікарського засобу S. aureus. У цьому випадку роблять пересівання підозрілих колоній, кожної окремо, у пробірки зі скошеним густим живильним середовищем №1 і інкубують при температурі від 35°С до 37°С від 18 до 24 год. Колонії, що виросли на середовищі №1, мікроскопують і при виявленні у мазках тільки грампозитивних коків, розташованих гронами, проводять тест на плазмокоагулазу.
Лікарський засіб витримує випробування, якщо на живильних середовищах не виявлений ріст грампозитивних коків, що ферментують маніт і дають позитивну реакцію плазмокоагуляції.
92

Для біохімічної ідентифікації мікроорганізмів можуть бути використані готові тест-системи.
Тест на плазмокоагулазу (реакція плазмокоагуляції). Кров, узяту стерильним шприцом із серця кролика, поміщають у 5%-ий стерильний розчин натрію цитрату, відбирають плазму, розводять у співвідношенні 1:5 стерильним розчином 9 г/л натрію хлориду і розливають по 0,5 мл у стерильні пробірки. У кожну пробірку помішають 1 петлю чистої добової культури стафілокока, що виросла на середовищі №1, і інкубують при температурі від 30°С до 35°С від 4 до 6 год. Якщо протягом цього часу не спостерігається згортання плазми, реакцію плазмокоагуляції вважають негативною. Одночасно з випробуванням проводять два контрольних досліди: 1) контроль розчину плазми, 2) контроль культури стафілокока, що дає позитивну реакцію на плазмокоагулазу.
Допускається використовувати суху кролячу цитратну плазму промислового виробництва, яку готують згідно з інструкцією щодо застосування.
Рід Escherichia.
Escherichia – найбільш розповсюджені бактерії кишечнику, які здатні за певних умов викликати чисельну кількість захворювань людини, як кишкової (діарея), так і поза кишкової(бактеремія, інфекції сечовивідних шліхів тощо), локалізації. Основний вид E.coli (кишкова паличка) – найрозповсюдженіший збудник інфекційних захворювань людини, які викликають ентеробактерії. Цей збудник є показником фекального забруднення, особливо води. Escherichia входять до складу нормальної мікрофлори товстого кишечнику ссавців, птахів, земноводних та риб.
Культуральні властивості. На рідких поживних середовищахE.coli дає дифузне помутніння, на твердих – утворює S- и R-форми колоній. На середовищі Ендо лактозоферментуючі кишкові палички утворюють інтенсивно забарвлені червоні колонії з характерним металевим блиском, ті, які не ферментують
– рожеві або безбарвні колоній з більш темним центром, на середовищі Плоскірева – червоні з жовтуватим відтінком, на середовищі Левина – темно-сині колонії з металевим блиском.
а |
б |
Рис. 8.2. Бактерії Escherichia coli:
у світловому (а) та електронному (б) мікроскопах
Морфологія. Грамнегативні паличковидні бактерії, короткі (довжина 1 – 3 мкм, ширина 0,5 – 0,8 мкм), поліморфні, рухомі або нерухомі, спор не утворюють. розташовуються поодиноко або короткими ланцюжками.
Постійно знаходяться в кишечнику людини і тварин, є показниками санітарного стану води.
Біохімічні властивості. E.coli в більшості випадків розщеплює вуглеводи (глюкозу, лактозу, маніт, арабінозу, галактозу тощо) з утворенням кислоти і га-
93
зу, утворює індол, але не утворює сірководень, не розріджує желатин, не володіє оксидазною активністю.
Фактори патогенності.
1.Фактори адгезії, колонізації та інвазій, що пов’язані з пілями, фімбріями, білками зовнішньої мембрани. Вони кодуються плазмідними генами і сприяють колонізації нижніх відділів тонкого кишечнику.
2.Екзотоксини: цитотоксини (стимулюють гіперсекрецію клітинами кишечнику рідини, порушують водно-сольовий обмін і сприяють розвитку діареї) і ентероцитотоксини (впливають на клітини стінок кишечнику і ендотелію капілярів).
3.Ендотоксин (ліпополісахарид).
4.Вироблення бактеріоцинів (коліцинів).
Залежно від наявності різних факторів патогенності кишкові палички розділені на п’ять основних груп: ентеротоксигенні, ентероінвазивні, ентеропатогенні, ентерогеморрагічні, ентероадгезивні. Ентеротоксигенні E.coli мають високомолекулярний термолабільний токсин, за направленістю дії схожий з холерним, викликають холероподібну діарею (гастроентерити у дітей, діарею мандрівників тощо). Ентероінвазивні E.coli здатні розповсюджуватися і розмножуватися в клітинах епітелію кишечнику. Викликають профузну діарею з домішками крові і великою кількістю лейкоцитів(показник інвазивного процесу) у випорожненнях. Клінічно нагадує дизентерію. Штами мають деяку подібність з шигелами – нерухомі, не ферментують лактозу, володіють високими ентероінвазійними властивостями). Ентеропатогенні E.coli – основні збудники діареї у дітей. В основі ураження – адгезія бактерій до епітелію кишечнику з пошкодженням мікроворсинок. Характерною ознакою є водяниста діарея і виразне зневоднення. Ентерогеморрагічні E.coli викликають кров’янисту діарею(геморрагічний коліт), гемолітико-уремічний синдром (гемолітична анемія у поєднанні з нирковою недостатністю). Ентероадгезивні E.coli не утворюють цитотоксини, вивчені слабко.
Виявлення E.coli у лікарському препараті. Відповідно 1 г або 1 мл лікарсь-
кого засобу, вносять у 100 мл живильного середовища №3 і інкубують при температурі від 35°С до 37°С від 18 до 24 год. Після закінчення інкубації роблять пересівання на густе живильне середовище №4 і інкубують при температурі від 35°С до 37°С від 18 до 24 год. Ріст характерних малинових колоній з металевим блиском або без нього або рожевих колоній діаметром від2 до 4 мм указує на можливість забруднення лікарського засобуЕ. соlі. У цьому випадку роблять пересівання підозрілих колоній, кожної окремо, на середовище №1 і інкубують при температурі від 35°С до 37°С від 18 до 24 год. Колонії, що виросли на середовищі №1, мікроскопують і при виявленні в мазках лише грамнегативних паличок проводять тест на цитохромоксидазу. У випадку негативної реакції проводять додаткові біохімічні тести на утилізацію цитрату і на індол.
Якщо на живильних середовищах виявлений ріст грамнегативних неспороутворюючих паличок, що не мають ферменту цитохромоксидази, не утилізують цитрат і утворюють індол, вважають, що лікарський засіб забруднений Е. соlі.
94
Тест на наявність цитохромоксидази. Смужку фільтрувального паперу змочують реактивом на цитохромоксидазу і наносять скляною паличкою чисту добову культуру випробовуваних бактерій, що виросли на середовищі №1. Синє забарвлення, що з’являється через 2 – 5 хв, свідчить про позитивну реакцію на цитохромоксидазу.
Тест на утилізацію цитрату. Роблять пересівання на густе живильне середовище №14 і інкубують при температурі від35°С до 37°С від 24 до 48 год. При наявності бактеріального росту утилізацію цитрату встановлюють за зміною кольору середовища із зеленого на синій.
Тест на індол. Роблять пересівання на рідке живильне середовище 15№. Посіви інкубують при температурі від 35°С до 37°С від 24 до 48 год. При наявності бактеріального росту наявність індолу встановлюють за появою червоного забарвлення при внесенні у середовище реактиву Ковача або Ерліха.
Рід Salmonella.
Сальмонели – велика група ентеробактерій, серед яких розрізняють серотипи – збудники черевного тифу, паратифу А, В та С та найбільш розповсюджених харчових токсикоінфекцій – сальмонельозів.
Культуральні та фізіолого-біохімічні властивості. Факультативні анаеро-
би, добре ростуть на простих поживних середовищах. Оптимум рН 7,2 – 7,4, температура +37°С. Метаболізм – окиснювальний та бродильний. Сальмонели ферментують глюкозу і інші вуглеводи з утворенням кислоти та га (Salmonella typhi газоутворення не викликає). Зазвичай не ферментують лактозу
(на середовищах з цим вуглеводом утворюють безбарвні колонії), сахарозу. Оксидаза – негативні, каталаза – позитивні. Реакція Фогес-Проскауера негативна.
На основі біохімічних(ферментативних) властивостей сальмонели розділені на 4 групи. Характерними ознаками сальмонел є утворення сірководню, відсутність продукції індолу і аеробність. Для виділення використовують дифе- ренційно-діагностичні середовища (вісмут-сульфіт агар, середовище Ендо, Плоскірєва, SS агар) і середовища збагачення (селенітовий бульйон, жовчний бульйон, середовище Рапопорта). S-форми утворюють дрібні (1 – 4 мм) прозорі колонії (на середовищі Ендо – рожеві, на середовищі Плоскірєва – безбарвні, на вісмут-сульфіт агарі – чорні з характерним металевим блиском). На рідких середовищах S-форми дають рівномірне помутніння, R-форми – осад.
Морфологія.
Прямі палички розміром2 – 4 × 0,5 мкм, грамнегативні. Рухомі, завдяки наявності перетріхіально розташованих джгутиків.
а |
б |
Рис. 8.3. Бактерії Salmonella typhi:
у світловому (а) та електронному (б) мікроскопах
95
Фактори патогенності. Основними факторами патогенності сальмонел є їх здатність проникати в макрофаги і розмножуватися в лімфоїдних утвореннях власне слизового шару тонкого кишечнику (пейєрові бляшки, солітарні фолікули), а також продукція ендотоксину.
1.Фактори адгезії і колонізації.
2.Здатність до внутрішньоклітинного паразитування, перешкоджають фагоцитозу, у збудників черевного тифу, паратифів А та В виражена здатність розмножуватися в клітинах лімфоїдної тканини, що призводить до хронічного носійства.
3.Ендотоксин (ЛПС).
4.Термолабільні та термостабільні ентеротоксини.
5.Цитотоксини.
6.Суттєвого значення набули плазміди вірулентності та R-плазміди.
7.Vi-антиген інгібує дію сироваткових і фагоцитарних бактерицидних фа-
кторів.
Патогенез уражень. Відмінності клінічних форм уражень, що викликані
сальмонелами, залежать від вірулентності і дози збудника та стану імунної системи. Зазвичай доза, яка викликає клінічні прояви – 106 – 109 бактерій. Сальмонели, що проникли перорально потрапляють досить легко в епітеліальні клітини дванадцятипалої кишки і тонкого кишечнику за рахунок ендоцитозу. В епітеліальних клітинах вони не розмножуються, а проходять і розмножуються в лімфатичному апараті тонкого кишечнику, що супроводжується місцевим запальним процесом слизової оболонки, притоком рідини до місця ураження і розвитком діарейного синдрому(гастроентерит). Ентеротоксини підвищують рівень цАМФ, відбувається підвищення рівня гістаміну і інших біологічно активних речовин, проникності судин. Спостерігаються водно-електролітні порушення, розвиваються гіпоксія і ацидоз, які сприяють розвитку патологічного процесу з перевагою судинних порушень. Відбувається руйнування частини сальмонел з вивільненням ендотоксину, сенсибілізація (ГСТ) лімфатичного апарату тонкого кишечнику. Зі слизової оболонки патогени можуть проникати в лімфо- і далі в кров’яне русло, викликаючи бактеремію.
На відміну від інших сальмонел, збудники черевного тифу та паратифів, потрапивши у кров’яне русло, здатні виживати і розмножуватися у фагоцитах. Вони розмножуються в мезентеріальних лімфовузлах, печінці, селезінці і викликають генералізацію процесу. Після загибелі фагоцитів сальмонели знов поступають у кров’яне русло, при цьому, Viантиген інгібує бактерицидні фактори.
Після загибелі сальмонел вивільняється ендотоксин, який пригнічує діяльність центральної нервової системи (тиф – з грец. typhos – туман, сплутана свідомість) і викликає тривалу лихоманку. Дія ендотоксину може викликати міокардит, міокардіодистрофію, інфекційно-токсичний шок.
Врезультаті бактеремії відбувається генералі зоване інфікування жовчного міхура, нирок, печінки, кісткового мозку, твердих мозкових оболонок. В сенсибілізованій сальмонелами стінці розвивається алергічне запалення з утворенням черевнотифозних язв. Потім відбувається формування післяінфекційного імунітету, елімінація збудника і загоєння ран або формування бактеріоносійства.
96

Виявлення Salmonella у лікарському препараті. Відповідно 1 г або 1 мл лі-
карського засобу, вносять у 100 мл живильного середовища №3 і інкубують при температурі від 35°С до 37°С від 18 до 24 год. Після закінчення інкубації роблять пересівання 1 мл з середовища №3 у 10 мл рідкого живильного середовища №12 і інкубують при температурі від35°С до 37°С від 16 до 18 год. Після закінчення періоду інкубації роблять пересівання із середовища №12 на поверхню густого живильного середовища №5 у чашках Петрі і інкубують при температурі від 35°С до 37°С від 24 до 48 год. Ріст чорних колоній із характерним металевим блиском, під якими ділянка середовища профарбовується у чорний колір, або світлих зеленуватих колоній указує на можливість забруднення -лі карського засобу Salmonella. У цьому випадку роблять пересівання підозрілих колоній, кожної окремо, у пробірки зі скошеним густим живильним середовищем №1 і інкубують при температурі від 35°С до 37°С від 18 до 24 год. Колонії, що виросли на середовищі №1, мікроскопують і при виявленні у мазках лише грамнегативних паличок проводять тест на цитохромоксидазу. У випадку негативної реакції роблять пересівання на густе живильне середовище №13, наносячи невелику кількість культури петлею спочатку на скошену частину живильного середовища, а потім уколом у стовпчик, і інкубують при температурі від 35°С до 37°С від 18 до 24 год. Якщо після закінчення періоду інкубації спостерігається зміна кольору середовища №13 із червоного на жовтий(у глибині агару, але не на його поверхні), що супроводжується, як правило, утворенням сірководню в глибині агару(наявність чорного забарвлення), вважають, що лікарський засіб забруднений Salmonella.
Рід Pseudomonas.
Представники роду – прямі або вигнуті палички, аероби, хемоорганотрофи, рухомі (мають полярно розташовані джгутики), крім P.mallei, спор не утворюють, оксидаза – позитивні, характеризуються низкою сахаролітичною активністю. Серед представників роду – мешканці ґрунтів і води, а також патогени рослин і тварин. P.aeruginosa (синьогнійна паличка) – один з основних збудників локальних і системних гнійно-запальних процесів в умовах медичних стаціонарів.
|
|
Морфологія. Грамнегативна пря- |
|||
|
|
ма або незначно вигнута паличка, |
|||
|
|
рухома, в мазках розташовують- |
|||
|
|
ся |
клітини |
поодиноко, парами |
|
|
|
або короткими ланцюжками. Си- |
|||
|
|
нтезує слиз (капсульну |
речови- |
||
|
|
ну), |
особливо |
більш |
вірулентні |
а |
б |
мукоїдні штами. |
|
||
Рис. 8.4. Бактерії Pseudomonas aeruginosa:
у світловому (а) та електронному (б) мікроскопах
Культуральні та фізіолого-біохімічні властивості. Аероб, має набір фер-
ментів, що відповідає типу дихання – цитохроми, цитохромоксидаза, дегідрази.
97
Росте в широкому діапазоні рН та температур. Обмежена необхідність в поживних речовинах сприяє росту цього збудника на простих універсальних поживних середовищах – МПБ, МПА, Ендо, Левіна тощо. На рідких поживних середовищах утворює сріблясто-сіру плівку. На щільних середовищах часто спостерігається феномен райдужного лізису. Вже на кінець доби внаслідок синтезу пігменту піоціаніну з’являється синьо-зелене забарвлення культури і в ряді випадків – самих середовищ (Мюллера-Хінтона, Мак Конки). Інші види псевдомонад можуть продукувати пігменти жовтого кольору із зеленою флюоресценцією (P.fluorescens, P.putida), червоний пігмент (піорубін), коричнево-чорний (піомеланін).
Для P.aeruginosa характерна низька сахаролітична активність(окислює тільки глюкозу), висока протеолітична активність і утворення на кров’яному агарі зони бета-гемолізу. Синтезує триметиламін, який надає культурам приємного запаху жасмину. Продукує вироблення бактеріоцинів – піоцинів.
Фактори патогенності. P.aeruginosa має великий набір факторів патогенності – ендотоксин (ЛПС, аналогічний іншим грамнегативним бактеріям), ряд екзотоксинів – цитотоксин, екзоензим S, гемолізини, екзотоксин А (найважливіший, нагадує дифтерійний екзотоксин), ферменти (колагеназа, нейрамінідаза, протеази).
Патогенез уражень. P.aeruginosa – патоген, позаклітинний паразит, розмноження якого пов’язане зі здатністю протидіяти захисним факторам організму. Збудник викликає важкі гнійно-септичні процеси(септицемія викликає загибель 30 – 70% пацієнтів). Це пов’язано з наявністю різноманітних факторів патогенності та R-плазмід, які обумовлюютьбагаточисленну стійкість до антибіотиків, до дії антисептиків та дезінфектантів.
Виявлення P. aeruginosa у лікарському препараті. Підготований зразок у кількості, відповідній 1 г або 1 мл лікарського засобу, вносять у 100 мл живильного середовища №8, гомогенізують і інкубують при температурі від 35°С до 37°С від 18 до 24 год. Після закінчення періоду інкубації роблять пересівання на чашку з густим живильним середовищем №9 і інкубують при температурі від 35°С до 37°С від 24 до 48 год. Ріст зеленуватих, як правило, флуоресціюючих колоній, блакитних в ультрафіолетовому світлі(що свідчить про наявність пігменту піоціаніну), указує на можливість забруднення лікарського засобуP. aeruginosa. У цьому випадку роблять пересівання підозрілих колоній, кожної окремо, в пробірки із скошеним густим живильним середовищем №1 й інкубують при температурі від 35°С до 37°С від 18 до 24 год. Колонії, що виросли на середовищі №1, мікроскопують і при виявленні у мазках тільки грамнегативних паличок проводять тест на цитохромоксидазу. Лікарський засіб витримує випробування, якщо на живильних середовищах не виявлений ріст грамнегативних паличок, що утворюють синьо-зелений пігмент піоціанін і дають позитивну реакцію на цитохромоксидазу.
98
Завдання на виконання
1. Аналіз досліду з визначення стерильності та мікробіологічної чистоти досліджуваних зразків лікарських препаратів. Заповнити підсумкову табл. 8.1 результатів з вивчення стерильності та мікробіологічної чистоти досліджуваних зразків лікарських препаратів:
Таблиця 8.1.
Кількісний облік мікроорганізмів у лікарському препараті
Назва |
Загальна |
Загальна |
Наявність (у кількісному вираженні) або |
|||
зразку |
кількість |
кількість |
|
відсутність |
||
|
бактерій |
грибів та |
E.coli |
S.aureus |
Salmonella |
P.aeruginosa |
|
|
дріжджів |
|
|
|
|
|
|
сумарно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Оформити протокол заняття, зробити висновки до лабораторної роботи.
Контрольні запитання
1.Які вимоги пред’являють щодо стерильності лікарських засобів?
2.Які вимоги пред’являють щодо мікробіологічної чистоти лікарських за-
собів?
3.Охарактеризуйте морфолого-культуральні та фізіолого-біохімічні ознаки окремих видів контамінантів лікарських засобів.
99
Додаток
Підготовка скляного посуду
Приготування хромової суміші. Біхромат калію (K2Cr2O7) розчинити у воді у фарфоровій чашці (розтерти пестиком з додаванням води) і обережно додати сірчану кислоту (не навпаки!). Суміш готують з розрахунку: вода – 10 мл, K2Cr2O7 – 6 г, H2SO4 – 100 мл. Суміш зберігають у посудині з кришкою.
Увага! Всі компоненти хромової суміші є дуже їдкими, тому всі роботи з нею слід проводити під витяжкою в гумових рукавицях, не допускаючи потрапляння компонентів на шкіру та слизові оболонки. Якщо суміш потрапила на руки або одяг, то забруднене місце слід негайно промити водою, потім розбавленим розчином аміаку або соди і знову водою. Після багаторазового викорис-
тання темно-помаранчевий колір хромової суміші змінюється на - темно зелений. Така суміш не придатна для миття посуду. Хромова суміш псується швидше, якщо занурювати в неї посуд, не промитий попередньо мильним розчином та водою. Крім того, занурений у хромову суміш вологий посуд знижує концентрацію сірчаної кислоти та прискорює її псування.
Скляний посуд замочують на декілька хвилин у теплому розчині детергенту (наприклад, прального порошку або господарського мила), промивають за допомогою йоржика та прополіскують проточною водою, доки не зникне піна. Після цього посуд промивають 3 – 4 рази дистильованою водою та висушують у сушильній шафі за температури100 – 120°С. Посуд має бути повністю висушений.
Посуд занурюють у хромову суміш. Дрібний посуд залишають у хромовій суміші на 2 – 3 год, великий – на добу. Після цього посуд виймають (обов’язково у гумових рукавицях!) та промивають 10 – 15 разів проточною водою і 3 – 4 рази – дистильованою, а потім висушують.
Перед стерилізацією пробірки, колби та флакони щільно закривають ватномарлевими пробками або фольгою. Чашки Петрі, шпателі, піпетки загортають у папір. Підготовлені скляні піпетки (у неробочий кінчик піпеток вставляють не дуже тугий ватний тампон, що відіграє роль повітряного фільтра) сортують за об’ємом та вкладають у пенали(за необхідності). Стерилізацію скляного посуду проводять у сухожаровій шафі за температури160 – 170°С упродовж не менш 2 год або автоклавують (при тиску 0,15 МПа протягом 40 хв)
100

Рецепти приготування реактивів, барвників, поживних середовищ
Лабораторна робота №1
1.1. Компоненти для приготування солі карловарської штучної(за ФС 42-
1615-81), г: |
|
|
Натрію |
сульфату безводного |
44 |
Натрію |
гідрокарбонату |
36 |
Натрію хлориду |
18 |
|
Калію сульфату |
2 |
|
1.2. Реактиви для проведення експрес-аналізу компонентів солі карловарської штучної:
Визначення гідрокарбонат-іонів:
-насичений розчин магнію сульфату MgSO4 (100 г магнію сульфату заливають 100 мл води і залишають на 24 год при постійному перемішуванні. Перед використанням розчин фільтрують.)
Визначення сульфатіонів:
-розчин барію хлориду (5 г BaCl2 на 95 мл дистильованої води). Визначення хлорид-іонів:
-0,1 н розчин нітрату срібла(17 г AgNO3 розчинити в 1 л дистильованої води. Розчин зберігати при температурі не вище +4°С).
Визначення іонів калію:
-розчин натрію кобальтонітриту (10 г Na3[Co(NO2)6)] розчиняють в 50 мл дистильованої води та, за необхідності, фільтрують).
Лабораторна робота №2
2.1. Кислота хлористоводнева розведена:
Змішують 1 ч хлористоводневої кислоти HCl з 2 ч дистильованої води до загального об’єму 100 мл.
2.2. 0,05 М розчин едетату натрію (трилону Б):
18,8 г трилону Б розчиняють у дистильованій воді в мірній колбі на 1 л, доводять об’єм розчину до мітки і фільтрують.
Визначення поправки до титру розчину едетату натрію.
а) Розчин цинку: близько 3,27 г (точна наважка) цинку металевого розчиняють у воді в мірній колбі на 1 л і доводять об’єм розчину водою до мітки.
б) До 25 мл приготованого розчину цинку додають5 мл аміачного буферного розчину, 0,1 г індикаторної суміші еріохрома чорного(або 5 крапель розчину), 70 мл дистильованої води, перемішують до розчинення індикатора і титрують розчином трилона Б до переходу фіолетового забарвлення в яскравосинє (без фіолетового відтінку). Поправку обчислюють за формулою:
К= 25 ,
V
де, 25 – об’єм розчину цинку, мл, V – об’єм розчину трилону Б, витраченого на титрування, мл.
2.3. Аміачний буферний розчин (рН 10,0)
101
На 100 мл розчину: 5,4 г амонію хлориду (NH4Cl) розчинити в 20 мл дистильованої води, додати 35 мл розчину аміаку 25%. Об’єм довести до 100 мл дистильованою водою у мірній колбі.
Приготування розчину аміаку: 67 мл концентрованого аміаку доводять дистильованою водою до 100 мл.
2.4.Індикаторна суміш кислотно-хромового темно-синього (або хромовий темно-синій).
Порошок темно коричневого кольору. В інтервалі рН 9,5 – 10,0 має синьофіолетове забарвлення, а його комплекси з іонами кальцію, магнію і цинку за тих же умов набувають вишнево-червоно кольору.
Добре розтерти у ступці і змішати0,25 г хромового темно-синього і25 г хлориду натрію х.ч. Термін зберігання 1 рік.
2.5.Розчин індикаторної суміші:
Наважку індикаторної суміші кислотно-хромового темно-синього масою 0,5 г розчиняють у 10 мл аміачного буферного розчину (рН 9,5 – 10) і доводять об’єм розчину до 100 мл 95° спиртом етиловим.
При прямому титруванні розчином індикаторної суміші відбувається перехід забарвлення від вишнево-червоно до синьо-фіолетового.
2.6. Фенолфталеїн 1% розчин:
Білий або жовтуватий дрібнокристалічний порошок без запаху і смаку. Перехід забарвлення від безбарвного до червоного в межах рН 8,2 – 10,0.
1%-ий розчин в 95° спирті: 1 г індикатора розчиняють в спирті і доводять 95° спиртом до 100 мл.
2.7. 0,1 М розчин натрію гідроксиду:
4,0 г натрію гідроксиду NaOH довести дистильованою водою у мірній колбі до 1000 мл.
2.8. 0,01 М розчин кислоти хлористоводневої:
1 мл HCl концентрованої довести дистильованою водою у мірній колбі до
1000 мл.
2.9. 0,05 М розчин йоду:
12,7 г х.ч. йоду та 20 г калію йодиду розчиняють у мінімальній кількості дистильованої води і доводять об’єм до1 л дистильованою водою. Розчин зберігають у темній склянці з притертою пробкою в захищеному від світла місці.
2.10. Розчин крохмалю:
1 г крохмалю розтирають у ступці з 5 мл дистильованої води до одержання однорідної маси і одержану суміш повільно вливають при постійному перемішуванні у 100 мл гарячої киплячої води. Кип’ятять протягом 2 – 3 хв до одержання слабкої опалесценції. Розчином можна користуватися не більше2 – 3 діб.
2.11. Кислота сірчана розведена:
167,7 мл концентрованої сірчаної кислоти додати до832,3 мл дистильованої води (кислоту у воду!). Вміст H2SO4 15,5 – 16,5%.
102
Лабораторна робота №3
Розчин желатину та натрію сульфату готують за1 добу до лабораторного заняття.
3.1. 8%-ий розчин желатину:
8 г желатину залишають набухати в 92 мл дистильованої води протягом 10 год за температури +8°С. Потім розчин нагрівають до 40°С і витримують 1 год. Об’єм розчину доводять водою дистильованою до 100 мл.
3.2. 20%-ий розчин натрію сульфату:
Сульфат натрію Na2SO4 попередньо прожарюють для одержання безводної солі. 20 г безводного Na2SO4 вміщують у мірну колбу на 100 см3, додають 80 мл води, підігрівають на водяній бані для прискорення розчинення солі, охолоджують і доводять дистильованою водою до мітки.
Лабораторна робота №4
4.1. Розчин залізоамонійного галуна:
а) 30 г галуна (квасців) залізоамонійного розчиняють в 100 мл води; до розчину додають розведену азотну кислоту(змішують 1 ч. азотної кислоти і 1 ч. дист. води) до переходу коричневого забарвлення у жовтувато-зелене. Розчин зберігають у захищеному від світла місці.
б) 1%-ий розчин. 1 г галуна (квасців) залізоамонійного розчиняють у воді і доводять об’єм водою до 100 мл.
4.2. 50° спирт:
520,8 мл 96° спирту розвести в 510,5 мл води.
4.3. 5%-ий розчин аміаку:
215,4 мл концентрованого аміаку розвести в 784,6 мл води.
4.4. 2 %-ий розчин алюмінію хлориду
Готують 2%-ий розчин алюмінію хлориду в 95% спирті: 2 г AlCl3 розчиняють в 98 мл 95° спирту.
4.5. 20%-ий спиртовий розчин α-нафтолу:
5,0 г α-нафтолу C10H7OH розчиняють у 40° етанолі та доводять об’єм розчину тим же спиртом до 100 мл. Розчин зберігають у темному скляному посуді
ухолодильнику.
4.6.Розчин йоду:
0,5 г кристалічного йоду та 1 г калію йодиду розчиняють в невеликій кількості води і розбавляють водою до100 мл. Розчин зберігають у посуді темного скла у захищеному від світла місці.
Лабораторна робота № 5
5.1. 4%-ий розчин оцтової кислоти:
39,3 мл концентрованої оцтової кислоти розвести в 1 л води.
5.2. Розчин натрію сульфіду:
2 г натрію сульфіду Na2S·9H2o розчиняють у воді, додають 2 – 3 краплини гліцерину і доводять об’єм розчину до100 мл. Зберігають розчин у скляному добре закупореному посуді в прохолодному захищеному від світла місці.
5.3. 5%-ий розчин соляної кислоти:
103
