- •1.Общие сведения об измерениях, испытаниях и контроле. Их роль в повышении качества продукции, услуг и производства. Основные задачи, решаемые путем проведения измерений, испытаний и контроля.
- •2.Основные элементы и признаки процесса испытаний, классификация по видам испытаний. Воздействующие факторы: внешние и внутренние. Методы и средства испытаний, испытательное оборудование.
- •3.Виды контроля, их классификация. Основные элементы процесса контроля. Основные этапы контроля.
- •4.Элементы процесса измерений: объект, принцип, метод, методика, средства измерения. Классификация измерений по видам измерений. Классификация средств измерений.
- •5.Измерительные преобразователи (классификация, структурная схема). Измерительные приборы (их классификация, структурная схема).
- •6.Основные элементы аналитического контроля: принцип, метод, методика, средства контроля (анализаторы).
- •7.Стадии аналитического процесса: отбор, подготовка пробы, проведение измерения, обработка результатов и последующий анализ полученной информации.
- •8.Классификация методов контроля состава и свойств веществ и материалов. Измерения и контроль механических, электрических, оптических и др. Физических свойств.
- •9.Измерение плотности (денсиметрические методы). Способы и средства измерения плотности. Измерение вязкости (вискозиметрические методы).
- •10.Акустические свойства сред. Звуковой и ультразвуковой методы контроля. Акустические методы неразрушающего контроля: активные, пассивные методы.
- •12.Измерение и контроль электрических свойств веществ и материалов. Электрохимические методы. Классификация электрохимических методов.
- •13.Электрохимическая ячейка (гальванический элемент и электролитическая ячейка). Индикаторный (рабочий) электрод и электрод сравнения.
- •16.Современные разновидности полярографии (осциллографическая, импульсная, переменно-токовая полярография). Вольтамперометрия, применение метода в аналитическом контроле органических веществ.
- •17.Кулонометрический метод, явление, лежащее в основе метода. Законы Фарадея. Прямая и косвенная кулонометрия. Средства кулонометрических измерений.
- •18.Электрогравиметрия в контроле качества поверхности твердых материалов.
- •19.Кондуктометрический метод. Приборы и датчики метода. Прямая кондуктометрия и кондуктометрическое титрование.
- •21.Взаимодействие вещества с электромагнитным излучением. Явление поглощения, испускания, флуоресценции, рассеяния и др.
- •22.Атомные и молекулярные спектры. Измеряемые величины методов. Получение и регистрация спектров. Средства измерения и контроля. Классификация методов.
- •23.Атомно-абсорбционная спектроскопия. Основной закон светопоглощения. Источники излучения и атомизации. Применение метода в контроле состава веществ.
- •24.Атомно-эмиссионная спектроскопия. Источники атомизации и возбуждения. Формула Ломакина-Шайбе. Разновидности метода: эмиссионная фотометрия пламени и др.
- •25.Атомно-флуоресцентная спектроскопия. Источники излучения. Область применение метода.
- •26.Молекулярная абсорбционная спектроскопия (в уф-видимой и ик-областях). Законы поглощения электромагнитного излучения. Основные характеристики поглощения.
- •27.Молекулярный спектр поглощения. Принципиальная схема прибора для измерения светопоглощения. Фотометрические методы: спектрофотометрия и фотоколориметрия.
- •28.Поглощение ик-излучения. Валентные и деформационные колебания. Характеристические частоты колебаний. Идентификация веществ, структурный анализ.
- •29.Флуоресцентная спектроскопия. Люминесценция, ее разновидности. Закон Стокса-Ломмеля. Схема прибора. Применение метода.
- •30.Спектроскопия рассеяния. Нефелометрия и турбидиметрия. Рассеяние излучения. Приборы для измерения светорассеяния.
- •31.Масс-спектроскопия. Ионизация. Способы возбуждения. Принципиальная схема масс-спектрометра. Расшифровка масс-спектров. Область применения метода.
- •32.Методы неразрушающего контроля.
- •33.Рентгеновская и электронная спектроскопия. Закон Мозли. Рентгеновская трубка. Поглощение и рассеяние.
- •Принцип действия и устройство
- •34.Рентгеноэмиссионный и рентгеноабсорбционный методы. Рентгенофлуоресцентная спектроскопия, сущность метода, схема прибора.
- •35.Рентгеновская фотоэлектронная спектроскопия.
- •36.Дифрактометрические методы.
- •37.Микроскопические методы.
- •38.Рефрактометрический метод.
- •41.Комбинированные и гибридные методы, их разновидности. Использование экстракции.
- •42.Использование хроматографии в гибридных методах (хромато-масс-спектроскопия и др.)
- •43.Классификация хроматографических методов. Принцип хроматографического разделения.
- •44.Схема хроматографа. Детекторы. Основные хроматографические параметры. Критерии оценки разделения.
- •45.Газо-жидкостная хроматография.
- •46.Высокоэффективная жидкостная хроматография, гельпроникающая и др. Методы. Их применение для контроля состава газовых и жидких сред.
25.Атомно-флуоресцентная спектроскопия. Источники излучения. Область применение метода.
Метод, основанный на измерении интенсивности излучения, возникающего в результате поглощения атомами вещества электромагнитного излучения другого оптического диапазона, называется методом атомно-флуоресцентной спектроскопии (АФС).
Под атомной флуоресценцией понимают дезактивацию состояний атомов, возбужденных за счет поглощения излучения.
В качестве источников первичного излучения (например, излучения УФ-диапазона) применяют: сплошные излучатели, лазеры и проч.
Источник первичного излучения располагают под углом к остальной оптической системе, чтобы детектор получал только флуоресцентный сигнал.
Измерение интенсивности испускаемого излучения видимого диапазона позволяет получить спектры флуоресценции – оптически возбужденные электронные спектры испускания атомов.
Интенсивность флуоресценции прямо пропорциональна концентрации вещества:
I fl = φfl ∙ Io ∙ kν ∙ l ∙ C
где kν — коэффициент поглощения;
φfl - квантовый выход флуоресценции; l - длина поглощающего пути;
С - концентрация атомов флуоресцирующего вещества; I fl - интенсивность флуоресценции; I0 - интенсивность падающего излучения
При постоянных условиях измерений значение I fl зависит только от концентрации вещества:
I fl = K ∙ C
На этом основано аналитическое применение АФС
Используя образцы сравнения, строят градуировочный график. Линейность градуировочных графиков наблюдается в пределах 5-7 порядков.
Область применения АФС в общем та же, что и ААС. АФС позволяет проводить количественные определения более 60 металлов и некоторых неметаллов в веществах различной природы:
- примесях и микропримесях неорганических веществ;
- технических материалах;
- нефти и нефтепродуктах;
- продуктах органического синтеза;
- пищевых продуктах,
- фармацевтических препаратах;
- объектах окружающей среды (воде, почве) и др.
Сравнительно высокие расходы на приборы окупаются большей чувствительностью по отношению ко многим элементам. Так лазерно-индуцированная АФС является одним из наиболее чувствительных методов.
26.Молекулярная абсорбционная спектроскопия (в уф-видимой и ик-областях). Законы поглощения электромагнитного излучения. Основные характеристики поглощения.
Этот метод применяется для:
1)идентификации веществ
2)для структурного анализа используют ИК-спектроскопию
3)для количественных определений веществ, которые могут находиться в любом состоянии (газообразном, твердом, жидком).
Метод позволяет определить как главные (основные) составные части, так и сопутствующие компоненты, т.е. примеси.
Диапазон определяемых содержаний составляет от низких десятков % до 10-4 или 10-5%.
Предел обнаружения 10-5 – 10-6 моль/л, может дойти до 10-7 моль/л.
Фотометрия в УФ-диапазоне характеризуется большей чувствительностью, чем ИК-спектроскопия. Поэтому молекулярно-абсорбционная спектроскопия в УФ и видимом диапазоне используют для определения микроколичественных веществ, т.е. для контроля средовых количеств, для контроля степени частоты, т.е. отчистки веществ (для контроля качества веществ). Можно сочетать эти методы с некоторыми приемами выделения концентрирования (т.е. речь идет о создании комбинированных и гибридных методах). Метод отличается не только высокой чувствительностью, но и высокой воспроизводимостью, так коэффициент вариации V(Sr) = 0,01 – 0,05.
Погрешность составляет в спектроскопии в УФ и видимых диапазонах 2-3% в спектрофотометрии и 5% в фотоколориметрии. В ИК-области >=5%.
Применяют для определения:
- большинства химических элементов (катионов, анионов)
- многих органических веществ
- некоторых биологических систем
- лекарственных препаратов
- используют метод в экологическом контроле
- для аналитического контроля производственных процессов, причем его можно осуществить в автоматическом режиме
- для анализа технологических смесей
Фотоколориметрический анализ (молекулярная абсорбционная спектроскопия) относится к оптическим методам анализа. Метод основан на способности вещества поглощать электромагнитное излучение оптического диапазона. Оптический спектр включает ультрафиолетовую, видимую и ИК-области. Фотометрический метод анализа широко применяют для решения проблем технологического контроля; в санитарно-гигиеническом анализе для определения аммиака, нитратов, катионов различных металлов в воде; для определения витаминов в продуктах питания и т.д. Метод имеет низкий предел обнаружения (10-5 – 10-6М), относительная ошибка большинства определений 1 – 2 %. В основе фотометрического метода анализа лежит избирательное поглощение света частицами (молекулами или ионами) вещества в растворе, при некоторых длинах волн светопоглощение происходит интенсивно, а при некоторых свет не поглощается. Поглощение квантов hν электромагнитного излучения оптического диапазона молекулой или ионом обусловлено переходом электронов на орбитали с более высокой энергией.
Атом, ион или молекула, поглощая квант света, переходит в более высокое энергетическое состояние. Обычно это бывает переход с основного, невозбужденного уровня на один из более высоких, чаще всего на первый возбужденный уровень. Вследствие поглощения излучения при прохождении его через слой вещества интенсивность излучения уменьшается и тем больше, чем выше концентрация светопоглощающего вещества.
Закон Бугера - Ламберта - Бера связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества, с концентрацией вещества и толщиной слоя. Чтобы учесть потери света на отражение и рассеяние, сравнивают интенсивности света, прошедшего через исследуемый раствор и растворитель При одинаковой толщине слоя в кюветах из одинакового материала, содержащих один и тот же растворитель, потери на отражение и рассеяние света будет зависеть от концентрации вещества.
Уменьшение интенсивности света, прошедшего через раствор, характеризуется коэффициентом пропускания (или просто пропусканием) T: T= I / I0, где I и I0 — соответственно интенсивности света, прошедшего через раствор и растворитель.
Взятый с обратным знаком логарифм T называется оптической плотностью A:
-lg T= -lg (I / I0 )=lg (I 0/ I)=A.
Уменьшение интенсивности света при прохождении его через раствор подчиняется закону Бугера-Ламберта-Бера: I=I0 10-e lc , или I / I0=10-e lc,или -lg T=A=e l c (1)
где e – молярный коэффициент поглощения; l – толщина светопоглощающего слоя;c – концентрация раствора.
Физический смысл e становится ясным, если принять I=1 см и c=1 моль/л, тогда A=e . Следовательно, молярный коэффициент поглощенияравен оптической плотности одномолярного раствора при толщине слоя 1 см.
Оптическая плотность раствора, содержащего несколько окрашенных веществ, обладает, свойством аддитивности, которое иногда называютзаконом аддитивности светопоглощения. В соответствии с этим законом поглощение света каким-либо веществом не зависит от присутствия в растворе других веществ. При наличии в растворе нескольких окрашенных веществ каждое из них будет давать свой аддитивный вклад в
Ограничения и условия применимости закона Бугера-Ламберта–Бера:
1. Закон справедлив для монохроматического света. Чтобы отметить это ограничение, в уравнение (1) вводят индексы и записывают его в виде: Al =e l l c. (2)
Индекс l указывает, что величины A и e относятся к монохроматическому излучению с длиной волны l .
2. Коэффициент e в уравнении (1) зависит от показаеля преломления среды. Если концентрация раствора сравнительно невелика, его показатель преломления остается таким же, каким он был у чистого растворителя, и отклонений от закона по этой причине не наблюдается.
3. Температура при измерениях должна оставаться постоянной хотя бы в пределах нескольких градусов.
4. Пучок света должен быть параллельным.
5. Уравнение (1) соблюдается только для систем, в которых светопоглощающими центрами являются частицы лишь одного сорта. Если при изменении концентрации будет изменяться природа этих частиц вследствие, например, кислотно-основного взаимодействия, полимеризации, диссоциации и т. д., то зависимость A от с не будет оставаться линейной, так как молярный коэффициент поглощения вновь образующихся и исходных частиц не будет в общем случае одинаковым.
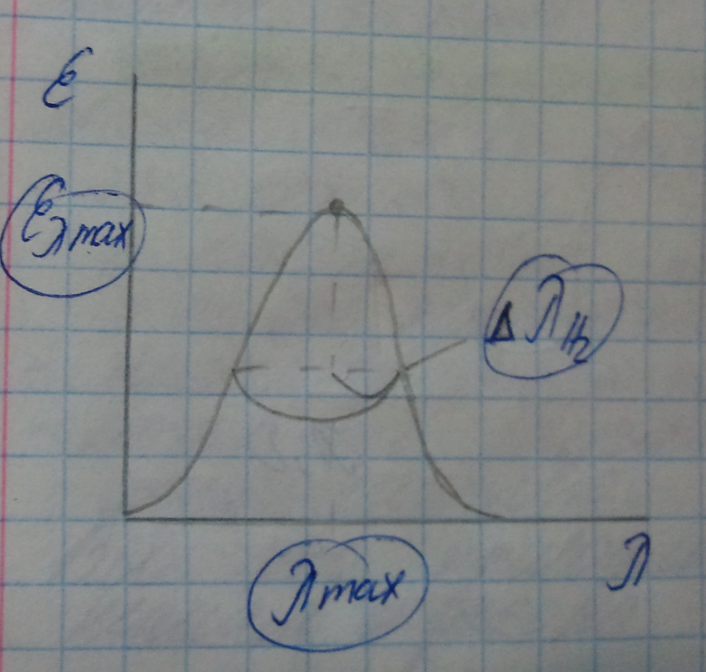
Спектральные характеристики: λmax – max длина волны, Ɛλmax – молярный коэффициент светопоглощения в точке max, ∆λH/2. Их используют для идентификации веществ. Поскольку они зависят от природы вещества, их используют для качественного анализа. Еще они зависят от условий физических измерений (от природы растворителя, рН и т.д.). Количественные характеристики зависят от концентрации, количества вещества, коэффициента пропускания.