
- •Федеральное агентство по образованию Российской Федерации
- •«Тюменский государственный нефтегазовый университет»
- •Методические указания
- •« Металлы. Коррозия металлов. Раздел Химические свойства металлов»
- •130503 «Проектирование, сооружение и эксплуатация нефтегазопроводов и нефтегазохранилищ» (нтх/ стх),
- •150202 «Оборудование и технология сварочного производства»
- •I. Лабораторная работа
- •Форма отчета: на 2 и 3 страницах
- •II. Вопросы для самоконтроля.
- •III. Рабочие задания. Задание № 1
- •IV. Химические свойства металлов
- •Взаимодействие металлов с водой
- •Взаимодействие металлов с водными растворами щелочей
- •Взаимодействие металлов с кислотами
- •V. Примеры выполнения заданий
- •625000Г. Тюмень, ул. Володарского, 38
- •625039 Г. Тюмень, ул. Киевская, 52
IV. Химические свойства металлов
Металлами называются простые вещества состоящие из атомов металлических элементов. Поэтому они способны только окисляться и являются только восстановителями.
M e
– ne = Me n+.
e
– ne = Me n+.
Восстановитель окисляется.
Активность металлов (способность вступать в реакции) определяется значением электродного потенциала металла в ряду стандартных электродных потенциалов (см. таблицу). Чем ниже значение электродного потенциала окисления металла, тем выше активность металла (тем легче идет окисление металла). Взаимодействие металлов с различными реагентами есть окислительно-восстановительный процесс. Поэтому реагенты являются окислителями, которые восстанавливаются.
Термодинамическая возможность протекания реакции взаимодействия металлов с реагентами определяется условием, что Э.Д.С. реакции должна быть положительной величиной:
Ереакции = eвосстановления - eокисления .
Взаимодействие металлов с водой
В воде окислителем является ион водорода (H+), который образуется при диссоциации:
H2O <=> H+ + OH-.
Так как вода, как слабый электролит, диссоциирует по равновесному процессу, то восстановление окислителя идет по уравнению
2H2O + 2e = H2 + 2OH-.
Электродный потенциал процесса восстановления ионов водорода из воды (где [H+] = 10-7 мол/л) по уравнению Нернста будет равен (−0,41В).
eH2O/H2 = 0 + 0,059 · lg 10-7 = –0,41В.
По способности взаимодействовать с водой металлы можно разделить на три группы.
1.Металлы, для которых электродный потенциал окисления больше –0,41В. Такие металлы термодинамически не взаимодействуют c водой, так как Э.Д.С. реакции – отрицательная величина.
2.Металлы, для которых электродный потенциал окисления в интервале от –0,41В до –2,36В (магний при комнатной температуре). Такие металлы термодинамически взаимодействуют с водой, так как Э.Д.С. реакции – положительная величина.
Однако образующийся в результате реакции гидроксид металла нерастворим в воде и защитная пленка прекращает реакцию. Происходит пассивация металла.
3.Металлы, для которых электродный потенциал окисления от –2,36В (магний при температуре кипения воды) и ниже. Такие металлы взаимодействуют с водой.
Таким образом, по взаимодействию с водой металлы можно классифицировать: инертные, пассивирующиеся и активные.
Взаимодействие металлов с водными растворами щелочей
При взаимодействии металла с водой в качестве продукта образуется гидроксид металла. Как известно, гидроксиды имеют кислотный (кислоты), основной (основания) и амфотерный характер.
Гидроксиды конструкционных металлов бериллия, алюминия, цинка, олова и свинца имеют амфотерный характер. Поэтому образующийся при взаимодействии с водой нерастворимый гидроксид металла проявляет свойства кислоты и вступает во взаимодействие с основанием (щелочью) образуя соли, растворимые в воде Таким образом, защитная пленка разрушается, и указанные конструкционные металлы реагируют с водой.
Взаимодействие металлов с кислотами
Характер взаимодействия, а также состав продуктов зависит от активности металла (восстановителя), активности кислоты (окислителя) и концентрации кислоты.
Металлы по отношению к кислотам классифицируют по активности:
а) активные – (электродный потенциал окисления меньше –1,18В);
б) средней активности – (электродный потенциал окисления от –1,18В до 0,0В);
в) малоактивные – (электродный потенциал окисления больше 0,0В).
Кислоты, как известно, диссоциируют на ион водорода (катион) и кислотный остаток (анион). В некоторых кислотах как катион, так и анион могут восстанавливаться. В зависимости от того, какой ион в кислоте является окислителем, возможны следующие направления реакции:
1.Взаимодействие металлов с кислотами, в которых окислителем является ион водорода (H+). Это все кислоты, кроме азотной кислоты и концентрированной серной кислоты.
Восстановление окислителя идет по уравнению
2H+ + 2e = H2
Электродный потенциал восстановления ионов водорода в стандартных условиях будет равен 0,0В. С такими кислотами взаимодействуют все металлы, электродный потенциал окисления которых меньше нуля, так как Э.Д.С. реакции – отрицательная величина.
Если образующиеся по реакции соли нерастворимы в воде, то защитный слой разделяет реагенты и происходит пассивация металла.
P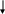 b
+ H2SO4
(разбавленная)
= H2
+ PbSO4
b
+ H2SO4
(разбавленная)
= H2
+ PbSO4
2.При взаимодействии металлов с концентрированной серной кислотой окислителем является сульфат-ион (SO42-).
Восстановление окислителя идет по уравнениям:
SO42- + 10H+ + 8e = H2S + 4H2O e0 = +0,30В,
SO42- + 8H+ + 6e = S + 4H2O e0 = +0,36В,
SO42- + 4H+ + 2e = SO2 + 2H2O e0 = +0,72В.
С концентрированной серной кислотой взаимодействуют все металлы до серебра, электродный потенциал окисления которого +0,80В.
Состав продуктов зависит от активности металла.
H 2SO4(конц.)
+ Me
(активн.) H2S
+ Me2(SO4)n
+ H2O
2SO4(конц.)
+ Me
(активн.) H2S
+ Me2(SO4)n
+ H2O
H2SO4(конц.) + Me (среднеактивн.) S + Me2(SO4)n + H2O
H2SO4(конц.) + Me (малоактивн.) SO2 + Me2(SO4)n + H2O
3.При взаимодействии металлов с азотной кислотой любой концентрации окислителем является нитрат-ион (NO3-).
Восстановление окислителя идет по уравнениям:
2NO3- + 12H+ + 10e = N2 + 6H2O e0 = +1,27В,
2NO3- + 10H+ + 8e = N2O + 5H2O e0 = +1,12В,
NO3- + 4H+ + 3e = NO + 2H2O e0 = +0,96В,
NO3- + 2H+ + 2e = NO2 + H2O e0 = +1,05В,
NO3- + 10H+ + 8e = NH4+ + 3H2O e0 = +0,86В.
С азотной кислотой взаимодействуют все металлы до золота, электродный потенциал окисления которого +1.50В. Причем разбавленная кислота является более сильным окислителем, чем концентрированная кислота.
Состав продуктов зависит от активности металла и концентрации кислоты.
H NO3(конц.)
+ Me(различн.активн.)
NO2
+ Me(NO3)n
+ H2O,
NO3(конц.)
+ Me(различн.активн.)
NO2
+ Me(NO3)n
+ H2O,
HNO3(очень разб.) + Me(активн.) NH4NO3 + Me(NO3)n + H2O,
HNO3(разб.) + Me(активн.) N2 + Me(NO3)n + H2O,
HNO3(разб.) + Me(среднеактивн.) N2O + Me(NO3)n+H2O,
HNO3(разб.) + Me(малоактивн.) NO + Me(NO3)n + H2O.
