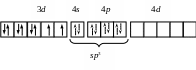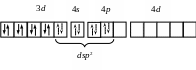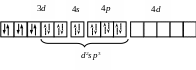- •По дисциплине «общая и неорганическая химия»
- •Строение комплексных соединений
- •Номенклатура комплексных соединений
- •Классификация комплексных соединений
- •Природа химической связи в комплексных соединениях
- •Метод валентных связей
- •Типы гибридизаций и геометрические конфигурации некоторых комплексов
- •Оптические свойства комплексных соединений
- •Устойчивость комплексных соединений
- •Примеры решения задач
- •Таким образом, в данном комплексном ионе имеет место sp3-гибридизация ао, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
- •Многовариантное задание № 1
- •Многовариантное задание № 2
- •Окраска вещества при поглощении веществом определённой части спектра
- •Константы нестойкости некоторых комплексных ионов при 25 с
- •Произведения растворимости малорастворимых электролитов при 25 °с
- •1 62600, Г. Череповец, пр. Луначарского, 5.
Типы гибридизаций и геометрические конфигурации некоторых комплексов
Тип гибридизации АО |
Комплекс и электронная структура центрального атома |
Структура внешних электронных оболочек комплексообразователя |
Геометри-ческая структура и магнитные свойства комплекса |
sp |
[Cu(NH3)2]+
Cu+: …3d104s0 |
|
Линейная Диамагнетик |
Продолжение табл. 1
sp3 |
[NiCl4]2–
Ni2+: …3d8 |
|
Тетраэдрическая Парамагнетик |
dsp2 |
[Ni(CN)4]2–
Ni2+: …3d8 |
|
Квадратная Диамагнетик |
d2sp3 |
[Co(NH3)6]3+
Со3+: …3d6 |
|
Октаэдрическая Диамагнетик |
sp3d2 |
[CoF6]3–
Со3+: …3d6 |
|
Октаэдрическая Парамагнетик |
Гибридизация с участием d-АО может быть двух видов:
1. С использованием внешних nd-орбиталей (например, 4d-АО в ионе [CoF6]3–). Такие комплексы называют внешнеорбитальными;
2. С использованием внутренних (n – 1) d-орбиталей (например, 3d-АО в комплексе [Ni(CN)4]2–). Их называют внутриорбитальными комплексами.
МВС является весьма наглядным, но не всегда может объяснить пространственное строение и магнитные свойства комплексов. Например, он не объясняет причин, вызывающих спаривание электронов в ионах [Ni(CN)4]2– и [Co(NН3)6]3–, т. е. нарушение правила Гунда при распределении электронов по d-АО.
Теория поля лигандов
ТПЛ дополняет МВС, успешно объясняя электрические, магнитные и химические свойства большинства КС. В основе данной теории лежит положение, что связь между комплексообразователем и лигандами обусловлена только электростатическими эффектами, т. е. является ионной или ион-дипольной. При этом не учитывается ковалентная природа связывания, возможность образования π-связей и строение лиганда. Согласно ТПЛ, лиганды – заряженные точки, а комплексообразователь рассматривается с детальным учетом его электронной структуры.
В свободном атоме или ионе АО любого d-подуровня пятикратно вырождены, т.е. все пять АО имеют одинаковую энергию. Если такую частицу поместить в центре ориентированных особым образом лигандов, то под действием их электростатического поля энергия АО d-подуровня комплексообразователя изменится.
Вне зависимости от числа и расположения лигандов вокруг центрального иона АО d-подуровня расщепляются на две группы новых орбиталей:
1) d серию, образованную dxy, dxz, dyz электронными облаками;
2)
d
серию, содержащую атомные орбитали d![]() и d
и d![]() .
.
В октаэдрическом поле лигандов (КЧ = 6) электроны d серии испытывают более сильное отталкивание со стороны лигандов, чем электроны dε серии, поэтому энергия d серии более высокая (рис. 1).
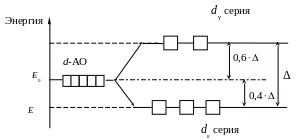
Р ис.
1. Расщепление d-АО
в октаэдрическом поле лигандов
ис.
1. Расщепление d-АО
в октаэдрическом поле лигандов
В тетраэдрическом поле лигандов (КЧ = 4) d-подуровень расщепляется по отношению к октаэдрическому полю в обратном порядке (рис. 2).
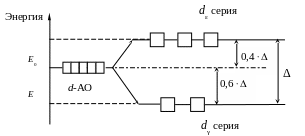
Рис. 2. Расщепление d-АО в тераэдрическом поле лигандов
Сумма
энергий АО d
и dε
серий, согласно закону сохранения
энергии, равна начальному значению
энергии Е0
вырожденных орбиталей. Разность между
энергиями новых подуровней
![]() называют энергией
(иначе
параметром)
расщепления.
называют энергией
(иначе
параметром)
расщепления.
Величина энергии расщепления для данного комплексообразователя определяется природой лиганда. Для 3d-элементов экспериментально установлен так называемый спектрохимический ряд, в котором слева направо численное значение Δ монотонно возрастает:
I– < Br– < –SCN– < Cl– < NO < F– < OH– < –ONO– < C2O < H2O <
< –NCS– < gly < py < H– < NH3 < Еn < –NC– < NO < CN– < CO
(подчеркнут атом, непосредственно связанный с комплексообразователем).
Лиганды левой части ряда называются лигандами слабого поля, так как они вызывают малое расщепление энергии d-подуровня. В этом случае величина Δ не превышает энергию взаимного отталкивания спаренных электронов, что приводит к заполнению АО электронами в соответствии с правилом Гунда (рис. 3).

Рис. 3. Распределение электронов d-подуровня в ионе Co3+ при
октаэдрическом расположении лигандов слабого поля
Лиганды правой части ряда – лиганды сильного поля – приводят к значительному расщеплению энергии d-подуровня, при этом величина Δ превышает энергию межэлектронного отталкивания спаренных электронов. Это означает, что энергетически более выгодно заполнять электронами АО с нарушением правила Гунда. Например, в случае октаэдрического расположения лигандов сильного поля электроны будут заполнять сначала по одному, а затем по второму АО dε серии, а затем в таком же порядке АО dγ серии (рис. 4). Для тетраэдрического поля порядок будет обратный.

Рис. 4. Распределение электронов d-подуровня в ионе Co3+ при
октаэдрическом расположении лигандов сильного поля
ТПЛ так же, как и МВС, позволяет объяснять магнитные свойства комплексов: при наличии неспаренных электронов комплекс парамагнитен, а при их отсутствии – диамагнитен. Однако в слабом октаэдрическом поле лигандов число неспаренных электронов всегда больше, чем в сильном. Поэтому комплексы с лигандами, создающими слабое октаэдрическое поле, называют высокоспиновыми, а с лигандами сильного поля – низкоспиновыми.