
- •Лабораторный практикум по органической химии (часть 1)
- •Содержание
- •Введение
- •Указания к подготовке и выполнению лабораторных работ
- •Правила техники безопасности при работе в лаборатории
- •Общие положения:
- •Работа со взрывоопасными веществами и приборами:
- •Работа с горючими веществами:
- •Работа с токсичными веществами:
- •Работа с кислотами и щелочами:
- •Действия в случае возникновения несчастного случая и оказание первой помощи:
- •Методы очистки органических соединений
- •Методики лабораторных работ
- •Лабораторная работа № 1. Качественный анализ органических соединений
- •4.2. Лабораторная работа № 2. Предельные углеводороды и непредельные ряда этилена и ацетилена
- •4.3. Лабораторная работа № 3. Галогенпроизводные углеводородов.
- •4.4. Лабораторная работа № 4. Ароматические углеводороды
- •Опыт 1. Получение бензола из бензойной кислоты
- •4.5. Лабораторная работа № 5. Спирты
- •4.6. Лабораторная работа № 6. Альдегиды и кетоны.
- •Контрольные вопросы:
- •4.7. Лабораторная работа № 7. Карбоновые кислоты и их производные.
- •4.8. Лабораторная работа № 8. Фенолы.
- •Опыт 7. Образование трибромфенола
4.4. Лабораторная работа № 4. Ароматические углеводороды
К ароматическим соединениям относятся бензол и вещества (толуол, нафталин), содержащие в своем составе бензольное ядро. Для ароматических углеводородов характерны тенденция реакции электрофильного замещения, например:
1) нитрование

нитробензол
2) алкилирование по Фриделю-Крафтсу

алкилбензол
Материалы: бензойная кислота; натронная известь (NaOH+CaO), бензол, толуол, ксилол, нафталин, 3 %-ный раствор брома в четыреххлористом углероде, концентрированная серная кислота, раствор перманганата калия, 10 %-ный раствор серной кислоты, концентрированная азотная кислота, хлористый алюминий, хлороформ; антрацен.
Опыт 1. Получение бензола из бензойной кислоты
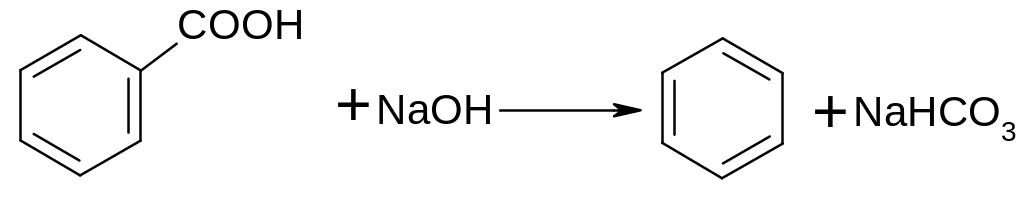
Тщательно смешивают 0,5 г бензойной кислоты и 2 г натронной извести (NaOH+CaO), полученной смесью заполняют пробирку на 1/3. Пробирку закрывают пробкой с газоотводной трубкой и закрепляют пробирку в лапке штатива под углом в 45 0С. Легким постукиванием добиваются образования канала над слоем реакционной смеси в пробирке. Газоотводную трубку погружают почти до дна в пробирку-приемник. Смесь в пробирке нагревают на горелке вначале осторожно, потом сильно. На дне приемника собирается несколько капель жидкого бензола. Знакомятся с его запахом. Можно поджечь бензол в вытяжном шкафу, он сгорает коптящим пламенем.
Опыт 2. Бромирование ароматических углеводородов


В три сухие отдельно пробирки помещают 1 мл бензола, 1 мл толуола, 0,5-1 г нафталина. В каждую пробирку добавляют по 1 мл 3 %-ного раствора брома в четыреххлористом углероде. После встряхивания делят каждую смесь на две части, отливая половину в чистую сухую пробирку. Одну часть нагревают в вытяжном шкафу до кипения. Признаками идущей реакции бромирования является исчезновения окраски брома и выделение дымящего на воздухе бромистого водорода.
В условиях опыта бромирование толуола протекает на холоде медленно, но вполне отчетливо. Нафталин постепенно растворяется и тоже бромируется (при нагревании быстрее). Бромирование бензола не обнаруживается даже при кипячении.
О![]() пыт
3. Сульфирование ароматических
углеводородов
пыт
3. Сульфирование ароматических
углеводородов
Опыт проводят одновременно с бензолом, нафталином и толуолом. К 0,5-1 мл (нафталина около 1 г) каждого из них добавляют по 3 мл концентрированной серной кислоты, после чего нагревают все пробирки в кипящей водяной бане при частом встряхивании. Смесь, содержащую бензол, нагревают более осторожно, не давая вскипать бензолу. Нафталин частично затвердевает на стенках пробирки выше уровня жидкости, и его следует повторно расплавлять осторожным прогреванием этих мест. При нагревании толуол и нафталин довольно быстро растворяются в серной кислоте с появлением слабого окрашивания.
Когда растворение закончилось (после 5-10 минут нагревания), охлаждают все три пробирки в стакане с водой; при этом лишь смесь, содержащая бензол, разделяется на два слоя. Затем выливают содержимое каждой пробирки в колбочку или стаканчик с 10-15 мл холодной воды. Бензол по-прежнему остается нерастворенным, а толуол и нафталин не выделяются даже при разбавлении водой, и продукты их сульфирования остаются в прозрачном водном растворе.
Опыт 4. Окисляемость ароматических углеводородов

Опыт проводят одновременно с бензолом и толуолом. Помещают в две пробирки по 1 мл раствора перманганата и по 1 мл раствора 10 %-ной серной кислоты. Затем добавляют в одну пробирку несколько капель бензола, а в другую - такое же количество толуола. Энергично встряхивают пробирки несколько минут. Наблюдают изменение окраски в одной из пробирок.
Опыт 5. Взаимодействие ароматических углеводородов с концентрированной азотной кислотой
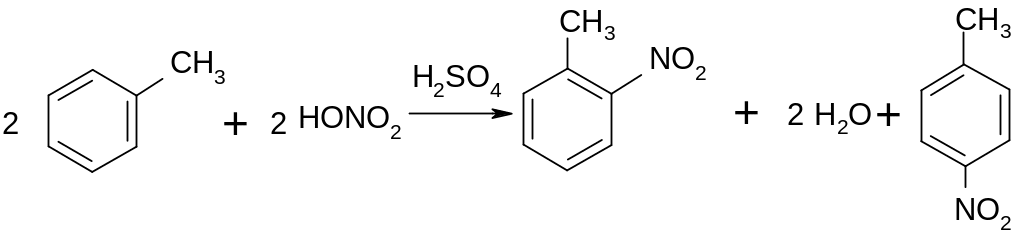

Опыт проводят одновременно с бензолом, ксилолом и толуолом. Помещают в три пробирки по 2 мл концентрированной азотной кислоты, добавляют в них соответственно по 5-7 капель одного из углеводородов. При сильном встряхивании жидкости во всех случаях образуют нестойкую, быстро расслаивающуюся эмульсию. Продолжая частое встряхивание, нагревают смеси в вытяжном шкафу почти до кипения, отмечая различие хода процесса в разных пробирках. Эмульсии становятся все более стойкими. После 5-7 минут нагревания со встряхиванием пробирки охлаждают и приливают в каждую из них по 6-7 мл холодной воды. Отмечают характерный запах продуктов реакции. Эти продукты в двух пробирках выделяются в виде тяжелого масла. Определить в пробирках с какими исходными веществами происходит выделение масла.
Опыт 6. Получение β-нафталинсульфокислоты
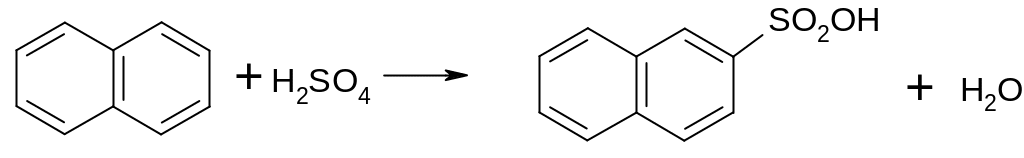
В сухой пробирке нагревают 1 г нафталина до плавления, затем охлаждают и добавляют к затвердевшему нафталину 1 мл концентрированной серной кислоты (опыт проводить в вытяжном шкафу). Очень осторожно нагревают смесь на пламени горелки, при встряхивании, в течение 1-2 минут до достижения полной однородности, затем дают остыть, добавляют к полученной густой темной жидкости 2 мл воды и снова слегка нагревают смесь. При охлаждении до 15-20 0С выделяются кристаллы β-нафталинсульфокислоты, которые можно отфильтровать на воронке и затем высушить. При добавлении к смеси, содержащей кристаллы, еще 3-5 мл воды сульфокислота полностью растворяется.
Опыт 7. Получение нитробензола

Готовят нитрующую смесь, смешивая в широкой пробирке или маленькой колбочке 1,5 мл концентрированной азотной кислоты и 2 мл концентрированной серной кислоты. Охладив в воде разогревшуюся смесь кислот, добавляют в нее по каплям 1 мл бензола при сильном, но осторожном встряхивании и охлаждении в воде. Наблюдается значительное разогревание; постоянным встряхиванием пробирки заставляют отделяющийся верхний слой вновь эмульгироваться в нижнем. Через 3-5 минут выливают реакционную смесь в другую пробирку с 10-15 мл воды, встряхивают ее и дают отстояться. Нитробензол выделяется в виде тяжелого желтоватого масла, мутного от капель воды.
Для удаления остатков кислот из пробирки нитробензол переносят пипеткой в пробирку с чистой водой и встряхивают, затем отделяют на делительной воронке, переносят в маленькую сухую пробирку и сушат кусочком сплавленного хлористого кальция при нагревании на водяной бане до полной прозрачности. После этого в нитробензоле остаются в качестве примеси лишь следы исходного бензола, от которого можно освободиться перегонкой (Т кип. = 211 0С).
Полученный нитробензол можно непосредственно применять для дальшего нитрования.
Опыт 8. Получение динитробензола

Работу следует проводить в вытяжном шкафу!
Готовят нитрующую смесь, смешивая в широкой пробирке или маленькой колбочке 1,5 мл концентрированной азотной кислоты и 2 мл концентрированной серной кислоты. В пробирку с нитрующей смесью, не ожидая ее охлаждения, добавляют около 1 мл нитробензола (из опыта № 7) и нагревают 15 минут на кипящей водяной бане, при частом встряхивании, для эмульгирования верхнего слоя. Затем охлаждают реакционную смесь и выливают ее в четырехкратный объем холодной воды. м-Динитробензол выделяется в виде тяжелого масла, которое быстро закристаллизовывается. В водном слое также вскоре появляется много красивых кристаллов динитробензола, окрашенных примесями в желтый цвет. Чистый продукт, перекристаллизованный из спирта, бесцветен и плавится при 90 0С.
Вдыхание паров динитробензола может вызвать головную боль.
Опыт 9. Получение нитронафталина
К 2 мл концентрированной азотной кислоты добавляют 0,5 г нафталина в порошке; при встряхивании смесь начинает желтеть уже на холоде. Нагревают смесь на кипящей водяной бане 5 минут при частом встряхивании, и затем выливают в четырехкратный объем холодной воды. Нитронафталин выделяется в виде оранжевого масла, быстро твердеющего при встряхивании. Выход почти теоретический. Продукт очищают перекристаллизацией из водного спирта.
Опыт 10. Конденсация ароматических углеводородов с галогенпроизводными в присутствии хлористого алюминия
Реакция между бензолом и хлороформом ведет в основном к образованию трифенилметана по уравнению:
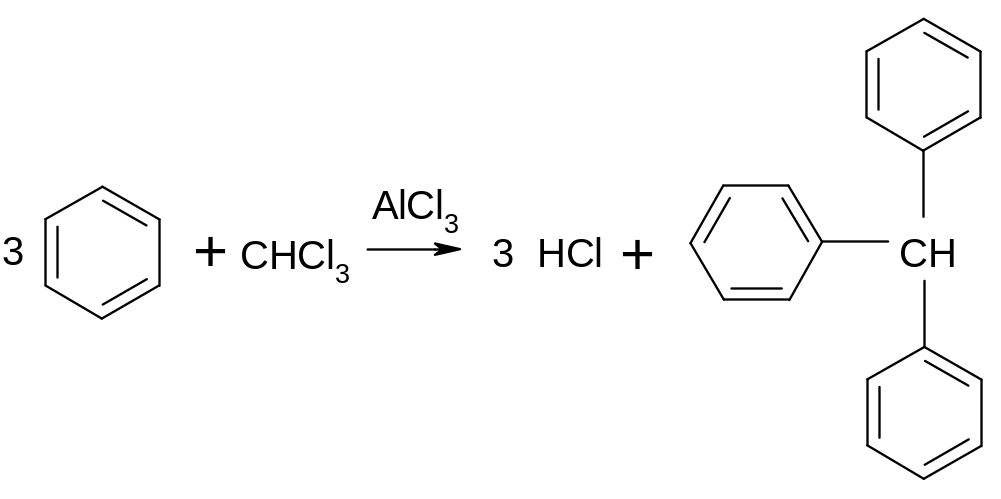
Опыт проводят в вытяжном шкафу! К 1 мл бензола в сухой пробирке добавляют немного 0,2-0,3 г хлористого алюминия и затем 0,5 мл хлороформа. При легком нагревании, а иногда и на холоде, начинается энергичная реакция, сопровождающаяся разогреванием и обильным выделением хлористого водорода, сильно дымящего на воздухе. Порошок хлористого алюминия превращается в густое окрашенное масло.
Хлористый алюминий образует с исходными, а иногда и с конечными продуктами реакции комплексные соединения, обычно маслообразные. Для выделения конечных продуктов из этих комплексных соединений их приходится по окончании реакции разлагать холодной соляной кислотой (Этот метод разработан французскими химиками Фриделем и Крафтсом в 1877г.).
Опыт 11. Получение антрахинона из антрацена
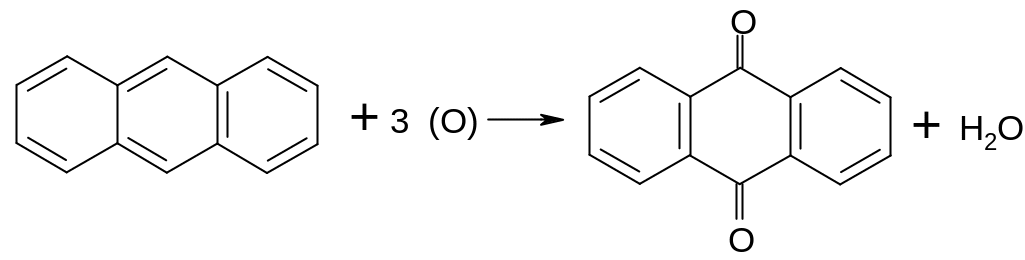
Смесь 0,1-0,2 г антрацена и 2 мл ледяной уксусной кислоты нагревают до кипения для перевода большей части антрацена в раствор, затем охлаждают, добавляют 2 мл концентрированной серной кислоты и приливают по каплям 1 мл 20 %-ного раствора бихромата натрия. Наблюдается сильное разогревание. Позеленевшую смесь кипятят несколько минут, затем охлаждают и выливают в 10-15 мл воды.
Из зеленого водного раствора выпадают желтоватые хлопья; их отфильтровывают через маленький фильтр и промывают горячей водой до обесцвечивания фильтра. Смыв осадок, воде дают стечь, отрывают кончик фильтра с осадком и помещают его в чистую пробирку. Добавив 2-3 мл разбавленного раствора щелочи и немного порошка цинка или алюминия, нагревают смесь до кипения.
Появление ярко-красного окрашивания жидкости, хорошо заметного после прекращения выделения водорода и исчезающего при взбалтывании, обнаруживает присутствие антрахинона. Нагревая со щелочью и порошком цинка или алюминия пробу исходного антрацена, убедитесь, что он не дает этой характерной для антрахинона реакции.
Опыт 12. Восстановление антрахинона
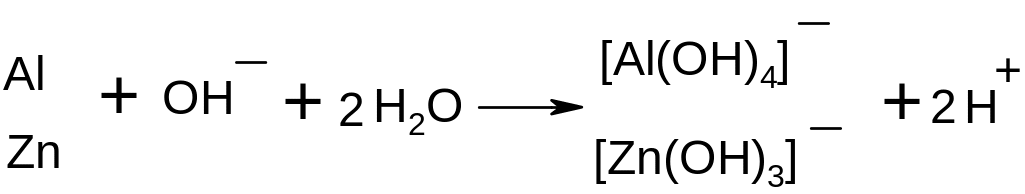

Поместив в пробирку несколько кристалликов антрахинона и 2-3 мл разбавленного раствора щелочи, нагревают смесь до кипения; видимых изменений при этом не наблюдается. После добавления порошка цинка или алюминия (немного) продолжают нагревание еще 1-2 мин., затем смесь охлаждают.
По окончании выделения пузырьков водорода обнаруживается ярко-красное окрашивание жидкости, при встряхивании раствор обесцвечивается. Нагреванием смеси с новой порцией порошка металла можно вновь вызвать покраснение раствора и снова обесцветить его встряхиванием.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Сравните поведение бензола и его гомологов в реакциях бромирования, окисления и нитрования. Охарактеризуйте активность бензола в этих реакциях.
Приведите формулы изомерных ароматических углеводородов состава C9H12. Дайте им названия.
Напишите схемы реакций бензола с:
а) хлором (в присутствии FeCl3);
б) хлором на свету при нагревании;
в) азотной кислотой в присутствии серной кислоты;
г) концентрированной серной кислотой.
В каком из изомерных ксилолов метильные группы проявляют согласованную ориентацию на реакции электрофильного замещения.
Какое строение имеют ароматические углеводороды состава C9H12, если при их окислении образуются:
а) бензойная кислота;
б) терефталевая кислота.
Сравните подвижность галогена в хлорэтане, хлорбензоле и хлористом бензиле. Предложите способы получения каждого из этих соединений, исходя из метана.
