
- •Лабораторный практикум по органической химии (часть 1)
- •Содержание
- •Введение
- •Указания к подготовке и выполнению лабораторных работ
- •Правила техники безопасности при работе в лаборатории
- •Общие положения:
- •Работа со взрывоопасными веществами и приборами:
- •Работа с горючими веществами:
- •Работа с токсичными веществами:
- •Работа с кислотами и щелочами:
- •Действия в случае возникновения несчастного случая и оказание первой помощи:
- •Методы очистки органических соединений
- •Методики лабораторных работ
- •Лабораторная работа № 1. Качественный анализ органических соединений
- •4.2. Лабораторная работа № 2. Предельные углеводороды и непредельные ряда этилена и ацетилена
- •4.3. Лабораторная работа № 3. Галогенпроизводные углеводородов.
- •4.4. Лабораторная работа № 4. Ароматические углеводороды
- •Опыт 1. Получение бензола из бензойной кислоты
- •4.5. Лабораторная работа № 5. Спирты
- •4.6. Лабораторная работа № 6. Альдегиды и кетоны.
- •Контрольные вопросы:
- •4.7. Лабораторная работа № 7. Карбоновые кислоты и их производные.
- •4.8. Лабораторная работа № 8. Фенолы.
- •Опыт 7. Образование трибромфенола
Методики лабораторных работ
Лабораторная работа № 1. Качественный анализ органических соединений
Для определения элементов, входящих в состав органических соединений, их предварительно нужно перевести в неорганические продукты. С помощью специальных химических превращений углерод переводят в углекислоту, водород - в воду, азот – в цианид натрия, серу – в сульфид натрия.
При выполнении этой работы необходимо использовать защитные очки, нагревать пробирку, направляя ее отверстие в сторону от себя и от окружающих вас людей.
Материалы: исходное испытуемое вещество (выдается по заданию преподавателя), оксид меди, баритовая или известковая вода (Ba(OH)2 или Ca(OH)2), металлический натрий, сульфат железа (II), 2 н раствор соляной кислоты, раствор нитрата свинца, 2 н раствор гидроксида натрия, раствор нитропруссида натрия.
Опыт 1. Определение углерода и водорода
При нагревании вещества, смешанного с оксидом меди, углерод, взаимодействуя с кислородом, образует оксид углерода (IV), водород – воду. Оксид меди при этом восстанавливается до металлической меди.
Немного испытуемого вещества смешивают на листе бумаги с порошком оксида меди, который берется в избытке. Смесь пересыпают в сухую пробирку с плотной пробкой и газоотводной трубкой. Пробирку закрепляют в лапке штатива (под углом в 45 0), закрывают газоотводной трубкой, и конец трубки вводят в другую пробирку, содержащую 3-4 мл прозрачной известковой или баритовой воды, так чтобы трубка была погружена в жидкость.
Смесь в пробирке нагревают сначала осторожно, затем сильнее. Образование воды обнаруживают по появлению капель на холодных частях пробирки и трубки, а образование углекислоты – по появлению белого осадка карбоната (бария или кальция).
Опыт 2. Определение азота
При сплавлении с органическим веществом металлический натрий отщепляет от него азот и углерод, образуя цианид натрия, который, реагируя с сульфатом железа (II), дает синюю окраску берлинской лазури.
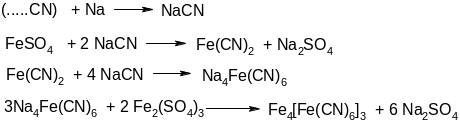
На дно сухой пробирки помещают немного испытуемого вещества и небольшой кусочек металлического натрия, пробирку осторожно нагревают до обугливания органического вещества. Натрий должен плавиться вместе с веществом. Слегка встряхивают пробирку, чтобы вещество обволокло натрий. Затем нагревают нижний конец пробирки до темно-красного каления, при этом может быть небольшая безопасная вспышка натрия.
Горячую пробирку резко опускают (разбивают) нижним концом в фарфоровую ступку с 7 мл воды. Эту операцию необходимо проводить в защитных очках, т.к. возможна сильная вспышка от оставшегося кусочка натрия. Содержимое ступки тщательно растирают пестиком, переносят смесь вместе с остатками стекла в другую пробирку, нагревают до кипения и отфильтровывают. Фильтрат делят на 3 равные части в чистые пробирки. К первой части фильтрата добавляют несколько кристалликов сульфатом железа (II) и кипятят эту смесь 1 минуту, охлаждают, дают постоять 3-4 минуты и подкисляют 2 н раствором соляной кислоты. Образование осадка берлинской лазури указывают на присутствие азота. Если азота мало, то раствор после подкисления окрашивается в зеленый цвет.
Опыт 3. Определение серы
При сплавлении натрий отщепляет от вещества серу с образованием сульфид натрия, который, реагируя с нитратом свинца в щелочной среде, образует сульфид свинца:

1) К 1 мл раствора нитрата свинца приливают 2 н раствор гидроксида натрия по каплям до растворения первоначально образовавшегося осадка гидроксида свинца и затем добавляют вторую часть фильтрата из предыдущего опыта. Появление темно-коричневой окраски или образование черного осадка сульфида свинца указывает, что исследуемое вещество содержало серу.
2) К 1 мл фильтрата (третья часть фильтрата из опыта 2) добавляют 1-2 капли раствора нитропруссида натрия. В присутствии серы смесь приобретает ярко-фиолетовую окраску. Нитропруссид натрия образует с сульфидом натрия нестойкое комплексное соединение.
Опыт 4. Проба Бельштейна на галогены
Тонкую проволоку из красной меди с петлей на конце прокаливают в бесцветном пламени горелки до прекращения окрашивания пламени. Дав остыть, набирают петлей немного испытуемого вещества и снова вводят петлю в пламя горелки. Присутствие галогенов вызывает появление красивого изумрудного окрашивания пламени. Это обусловлено образованием летучих при высоких температурах галогенидов меди.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
В виде каких неорганических соединений открывают водород и углерод? Как эти соединения обнаруживают? Зачем в реакционную смесь добавляют оксид меди?
Какие неорганические азот- и серосодержащие вещества образуются после сплавления органического вещества с металлическим натрием? Какими качественными реакциями их можно обнаружить?
Почему, при наличии галогена в органическом соединении при внесении его на медной проволоке в огонь происходит окрашивание пламени?
