- •Термохімія
- •Молекулярність і порядок реакції
- •Кінетика необоротних реакцій
- •Необоротна реакція першого порядку
- •Необоротна реакція другого поряду
- •3.1 Електрохімічні процеси та їхнє медико-біологїчне значення. Розчини електролітів.
- •3.3 Кондуктометричне визначення ступеня та константи йонізації слабкого електроліту. Закон розведення Оствальда.
- •3.4 Кондуктометричне титрування. Застосування кондуктометрії в медицині.
- •4.1 Електродні потенціали та механізм їх виникнення. Рівняння
- •4.3 Електрохімічні (гальванічні) елементи та електрорушійні сили.
- •4.4. Дифузійні та мембранний потенціали, їхнє біологічне значення. Рівняння Нернста.
- •4 .5 Потенціометрія: потенціометричне визначення рН за допомогою воднево-хлорсрібного та хлорсрібного скляного елемента. Потенціометричне титрування.
- •Ізотерма адсорбції Ленгмюра
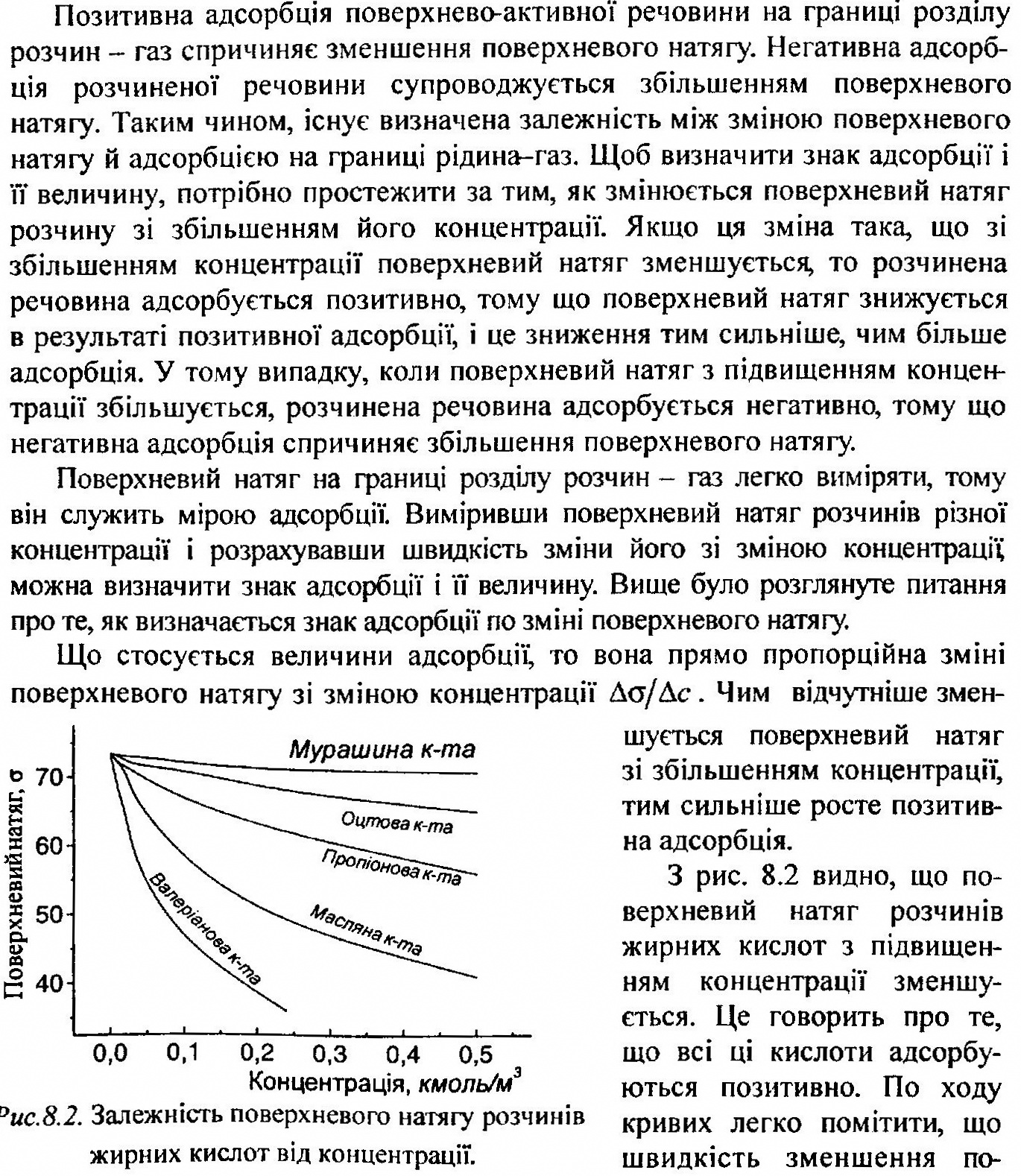
- •5.2 Адсорбція на межі поділу рідина - газ та рідина - рідина. Рівняння Гіббса. Орієнтація молекул поверхнево-активних речовин у поверхневому шарі.
- •5.3 Уявлення про структуру біологічних мембран. Адсорбція на межі поділу тверде тіло - газ.
- •5.4 Адсорбція із розчину на поверхні твердого тіла. Фізична та хімічна адсорбція. Закономірності адсорбції розчинених речовин, парів та газів. Рівняння Фрейндліха.
- •6.1 Адсорбція електролітів: специфічна (вибірна) та йонообмінна. Правило Панета- Фаянса.
- •6.2. Йонообмінники природні та синтетичні. Роль адсорбції та йонного обміну в процесах життєдіяльності рослин і організмів.
- •6.3. Хроматографія. Класифікація хроматографічних методів аналізу за ознакою агрегатного стану фаз, техніки виконання та механізму розподілу. Адсорбційна, йонообмінна та розподільча хроматографія.
- •6.4. Застосування хроматографії в біології та медицині. (спрс)
- •7.1 Загальна характеристика дисперсних систем: основні визначення та класифікація.
- •7.3 Електричні властивості колоїдно-дисперсних систем: механізм утворення подвійного електричного шару. Рівняння Гельмгольца-Смолуховського. Електрофоретична рухливість.
- •7.4 Електрокінетичні явища: електроосмос, електрофорез, потенціали перебігу та седиментації. Застосування електрофорезу в дослідницькій та клініко-лабораторній практиці.(спрс)
- •8.1 Стійкість та коагуляція дисперсних систем. Коагуляція гідрофобних золів під дією електролітів. Поріг коагуляції. Правило Шульце—Гарді.
- •9.1 Високомолекулярні сполуки - основа живих організмів. Глобулярна та фібрилярна структура білків. Порівняльна характеристика розчинів високомолекулярних сполук, істинних та колоїдних розчинів.
- •9.3 Аномальна в'язкість розчинів вмс. В'язкість крові. Мембранна рівновага Доннана.
- •9.4 Ізоелекгричний стан білка. Ізоелєктрична точка та методи її визначення. Йонний стан біополімерів в водних розчинах.
- •9.5 Значення високомолекулярних сполук (вмс) у медицині та фармації. (спрс).
Ізотерма адсорбції Ленгмюра
Якщо над поверхнею сорбента є певна кількість молекул газу або пари, то внаслідок броунівського руху молекули газу будуть стикатися з поверхнею і осідати на ній. Час, протягом якого молекула залишається на поверхні адсорбента, характеризує здатність даної речовини адсорбуватись на даній поверхні: чим більший час, тим більша здатність до адсорбції. Якщо розглядати явище адсорбції в часі, то спочатку швидкість прямого процесу адсорбції, тобто процесу осідання молекул на поверхню адсорбенту, більше швидкості зворотного процесу десорбції тобто процесу відриву молекул від поверхні. В міру протікання процесу швидкість адсорбції зменшується, а швидкість десорбції збільшується доти, поки ці швидкості не зрівняються між собою. З цього моменту в системі встановлюється динамічна рівновага між молекулами адсорбтива, що знаходяться на поверхні й в об'ємі.
З моменту встановлення адсорбційної рівноваги швидкості адсорбції і десорбції стають рівними: число молекул адсорбтива, що притягаються до даної поверхні в одиницю часу, дорівнює числу молекул, що відриваються від цієї поверхні в ту ж одиницю часу. До встановлення адсорбційної рівноваги концентрація адсорбтива в об'ємі поступово зменшується, а його концентрація на поверхні адсорбенту збільшується; з моменту встановлення рівноваги обидві концентрації залишаються постійними (при постійній температурі). Концентрація, що відповідає стану рівноваги, називається рівноважною концентрацією,
Адсорбційна рівновага, як і всяка рухлива рівновага, залежить від умов процесу, а саме від температури і від концентрації адсорбтива
Згідно з запропонованою у 1916 році Ленгмюром моделлю адсорбції, між молекулами адсорбату відсутня взаємодія. Це проявляється в тому, що адсорбовані молекули на поверхні заважають адсорбуватися іншим з газової фази. Так, якщо поверхня адсорбенту частково вкрита адсорбованими молекулами, то при зіткненні молекул з газової фази, ті що вдаряються в адсорбовані молекули відбиваються в газову фазу. З цього випливає, що адсорбований шар повинен бути мономолекулярним, тобто вкритий тільки одним шаром молекул.
На основі молекулярно-кінетичної теорії Ленгмюр вивів ізотерму адсорбції:
b p
a = am ---------- (1)
1 + b p
де а - величина адсорбції; ат -гранична величина адсорбції; р - тиск пари адсорбату над поверхнею; b - стала.
Вираз (1) з рівнянням ізотерми Ленгмюра і графічно може бути представлений у вигляді кривої (рис.8.3). По вісі абцис відкладено тиск пари адсорбату, а по вісі ординат - кількість адсорбованої речовини в молях на 1 см2. Представлену на рис. 8.3 криву можна розбити на дві частини. Початкова ділянка кривої (при дуже малих тисках) має майже лінійний хід. Рівняння (1) в цьому випадку приймає вигляд a-=аmp , яке виражає пряму пропорційність між кількістю адсорбованого газу і його тиском. В більшості випадків така закономірність спостерігається експериментальне при адсорбції різних газів на поверхні твердих тіл. В області високих тисків член bр у рівнянні (1) стає значно більшим одиниці, і рівняння приймає вигляд а = аm і показує, що кількість адсорбованого газу
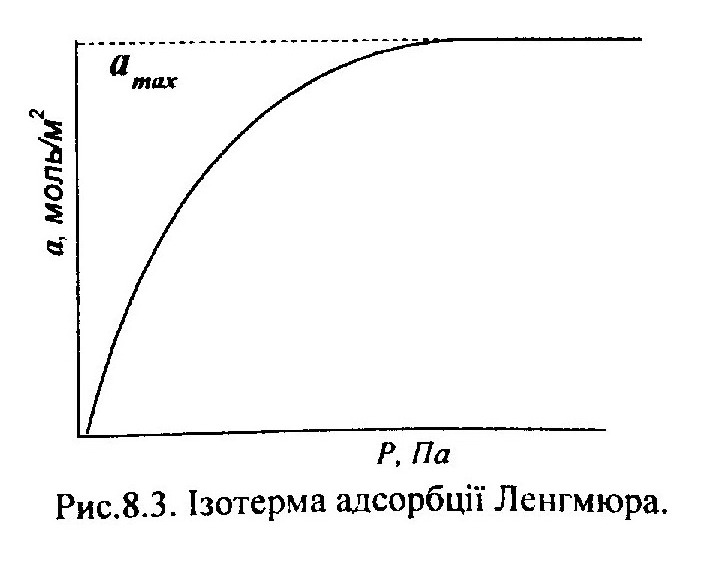
не змінюється при подальшому збільшенні тиску, що дійсно відповідає адсорбційній ізотермі при підвищених тисках.
Ізотерми адсорбції розчинених речовин з розчину по своєму вигляду в загальному аналогічні адсорбційним ізотермам для газів, і до них теж може бути застосоване рівняння (1), якщо в ньому замість тиску газу підставити концентрацію с розчиненої речовини в розчині. Але адсорбція з розчинів виявляється значно більш складним явищем порівняно з газовою адсорбцією, оскільки поряд з адсорбцією розчиненої речовини на поверхні адсорбента може відбуватись і адсорбція самого розчинника Тому тут зустрічаються частіше різного роду відхилення.
Іншим рівнянням ізотерми адсорбції, що дає гарні результати у випадку адсорбції газів на поверхні твердих тіл, є знайдене емпіричним шляхом рівняння, що називається рівнянням Фрейндліха:
х
— = kс1/n, (8.2)
m
де х — кількість адсорбованої речовини, що виражається звичайно в мілімолях; m- наважка адсорбенту в грамах; с - рівноважна концентрація адсорбтива; k і n- сталі величини (для даного випадку адсорбції).
Константа k - це кількість речовини, адсорбованої 1 кг адсорбенту при рівноважній концентрації, що дорівнює одиниці. Для кожного адсорбтива константа k має своє особливе чисельне значення при одному і тому адсорбенті, тобто вона характеризує здатність даного адсорбтива адсорбуватися визначеним адсорбентом. Константа п також має різні значення для різних речовин, що адсорбуються тим самим адсорбентом. Значення адсорбції, обчислені за допомогою рівняння (2), збігаються з експериментальними даними тільки в області середніх концентрацій адсорбтива, цей недолік обмежує можливості застосування цього рівняння.