
- •Термохімія
- •Молекулярність і порядок реакції
- •Кінетика необоротних реакцій
- •Необоротна реакція першого порядку
- •Необоротна реакція другого поряду
- •3.1 Електрохімічні процеси та їхнє медико-біологїчне значення. Розчини електролітів.
- •3.3 Кондуктометричне визначення ступеня та константи йонізації слабкого електроліту. Закон розведення Оствальда.
- •3.4 Кондуктометричне титрування. Застосування кондуктометрії в медицині.
- •4.1 Електродні потенціали та механізм їх виникнення. Рівняння
- •4.3 Електрохімічні (гальванічні) елементи та електрорушійні сили.
- •4.4. Дифузійні та мембранний потенціали, їхнє біологічне значення. Рівняння Нернста.
- •4 .5 Потенціометрія: потенціометричне визначення рН за допомогою воднево-хлорсрібного та хлорсрібного скляного елемента. Потенціометричне титрування.
- •Ізотерма адсорбції Ленгмюра
- •5.2 Адсорбція на межі поділу рідина - газ та рідина - рідина. Рівняння Гіббса. Орієнтація молекул поверхнево-активних речовин у поверхневому шарі.
- •5.3 Уявлення про структуру біологічних мембран. Адсорбція на межі поділу тверде тіло - газ.
- •5.4 Адсорбція із розчину на поверхні твердого тіла. Фізична та хімічна адсорбція. Закономірності адсорбції розчинених речовин, парів та газів. Рівняння Фрейндліха.
- •6.1 Адсорбція електролітів: специфічна (вибірна) та йонообмінна. Правило Панета- Фаянса.
- •6.2. Йонообмінники природні та синтетичні. Роль адсорбції та йонного обміну в процесах життєдіяльності рослин і організмів.
- •6.3. Хроматографія. Класифікація хроматографічних методів аналізу за ознакою агрегатного стану фаз, техніки виконання та механізму розподілу. Адсорбційна, йонообмінна та розподільча хроматографія.
- •6.4. Застосування хроматографії в біології та медицині. (спрс)
- •7.1 Загальна характеристика дисперсних систем: основні визначення та класифікація.
- •7.3 Електричні властивості колоїдно-дисперсних систем: механізм утворення подвійного електричного шару. Рівняння Гельмгольца-Смолуховського. Електрофоретична рухливість.
- •7.4 Електрокінетичні явища: електроосмос, електрофорез, потенціали перебігу та седиментації. Застосування електрофорезу в дослідницькій та клініко-лабораторній практиці.(спрс)
- •8.1 Стійкість та коагуляція дисперсних систем. Коагуляція гідрофобних золів під дією електролітів. Поріг коагуляції. Правило Шульце—Гарді.
- •9.1 Високомолекулярні сполуки - основа живих організмів. Глобулярна та фібрилярна структура білків. Порівняльна характеристика розчинів високомолекулярних сполук, істинних та колоїдних розчинів.
- •9.3 Аномальна в'язкість розчинів вмс. В'язкість крові. Мембранна рівновага Доннана.
- •9.4 Ізоелекгричний стан білка. Ізоелєктрична точка та методи її визначення. Йонний стан біополімерів в водних розчинах.
- •9.5 Значення високомолекулярних сполук (вмс) у медицині та фармації. (спрс).
8.1 Стійкість та коагуляція дисперсних систем. Коагуляція гідрофобних золів під дією електролітів. Поріг коагуляції. Правило Шульце—Гарді.
Частинки речовини, диспергованої в газі або рідині, зазнають дії двох протилежно направлених сил. Це сила тяжіння, під дією яких частинки речовини прагнуть осісти на дно посудини, та сили дифузії, під впливом яких іде вирівнювання концентрацій диспергованих частинок.
Здатність дисперсної системи зберігати рівномірне розподілення частинок по всьому об'єму диспергуючого середовища називається седиментаційною, або кінетичною стійкістю розчину, яка зумовлена броунівським рухом частинок.
Кінетична стійкість колоїдної системи залежить від дії двох факторів, які спрямовані в протилежних напрямках: сил тяжіння, під дією якої частинки осідають, і дифузії, при якій частинки прагнуть розійтись по всьому об'єму і протидіють осіданню.
Процес осідання частинок під дією сили тяжіння називають седиментацією (від sedimenttatio). На кожну частинку у системі діє сила тяжіння (гравітаційна сила) і сила Архімеда:
Fg = mg = vρg і FA = vpog, (1)
де m і v - маса і об'єм частинки; g - прискорення вільного падіння; р і рo -густина частинок дисперсної фази і дисперсійного середовища відповідна
Ці сили постійні і спрямовані протилежно. Рівнодіюча сила, що викликає седиментацію, дорівнює:
Fседем. = Fg - FA = mвідн..g = v(p - po)g (2)
де mвідн - відносна маса частинки (з урахуванням густини середовища, mвідн = m - vpo).
Якщо р > рo то Fседем > 0, і відбувається осідання частинки; якщо р < рo то Fседем < 0 і частинка вспливає, тобто спостерігається обернена седиментація, яка властива для газових і більшості рідких емульсій.
Оскільки седиментація відбувається у певному середовищі, то при русі частинки виникає сила тертя, яка пропорційна швидкості руху частинки:
Fтертя = B.u, (3)
де В - коефіцієнт тертя; u - швидкість руху частинки.
Таким чином, сила, що діє на частинку, дорівнює:
F= Fседем - Fтертя = vg = v(p - po) - B.u, (4)
На початку руху частинки її швидкість дуже мала, тому частинка рухається під дією сили F з прискоренням. Але при збільшенні швидкості осідання сила тертя зростає, досягаючи величини сили, яка викликає седиментацію, тобто рушійна сила стає рівною нулю (F = 0 ). Після цього моменту швидкість осідання частинки й залишається постійною величиною, і її можна визначити з рівняння (4) при умові F= 0:
vg(p - po)
u =------------------ (5)
B
Сила тертя при русі сферичних частинок виражається законом Стокса
Fтертя = 6πηru і B = 6πηr (6)
де η - динамічна в'язкість; r- радіус частинки.
Підставляючи рівняння (6) у (5) і виражаючи об'єм частинки через її радіус, одержуємо:
2g(p - po)r2
u =------------------ (7)
9η
З останнього рівняння видно, що швидкість седиментації частинки пропорційна квадрату її радіусу, різниці густіли частинки і середовища, і обернено пропорційна в'язкості середовища.
У відповідності з цим рівнянням скоріше всього осідають частинки великих розмірів (коли великі радіуси r), а дрібні частинки осідають повільніше. Рівняння (7) можна розв'язати відносно радіуса частинки r.


 9 πηu
9 πηu
r = ----------- (8)
2g(p - po)
Визначивши експериментальне швидкість седиментації і знаючи величини η , р і рo за рівнянням (8) можна розрахувати радіус частинки.
При достатньо високому ступені дисперсності частинки зависають у розчині - це так звана седиментаційна рівновага. При такій рівновазі швидкість седиментації і дифузії рівні, тобто через одиницю поверхні перерізу в одиницю часу вниз за рахунок седиментації проходить стільки ж частинок, як і вверх за рахунок дифузії.
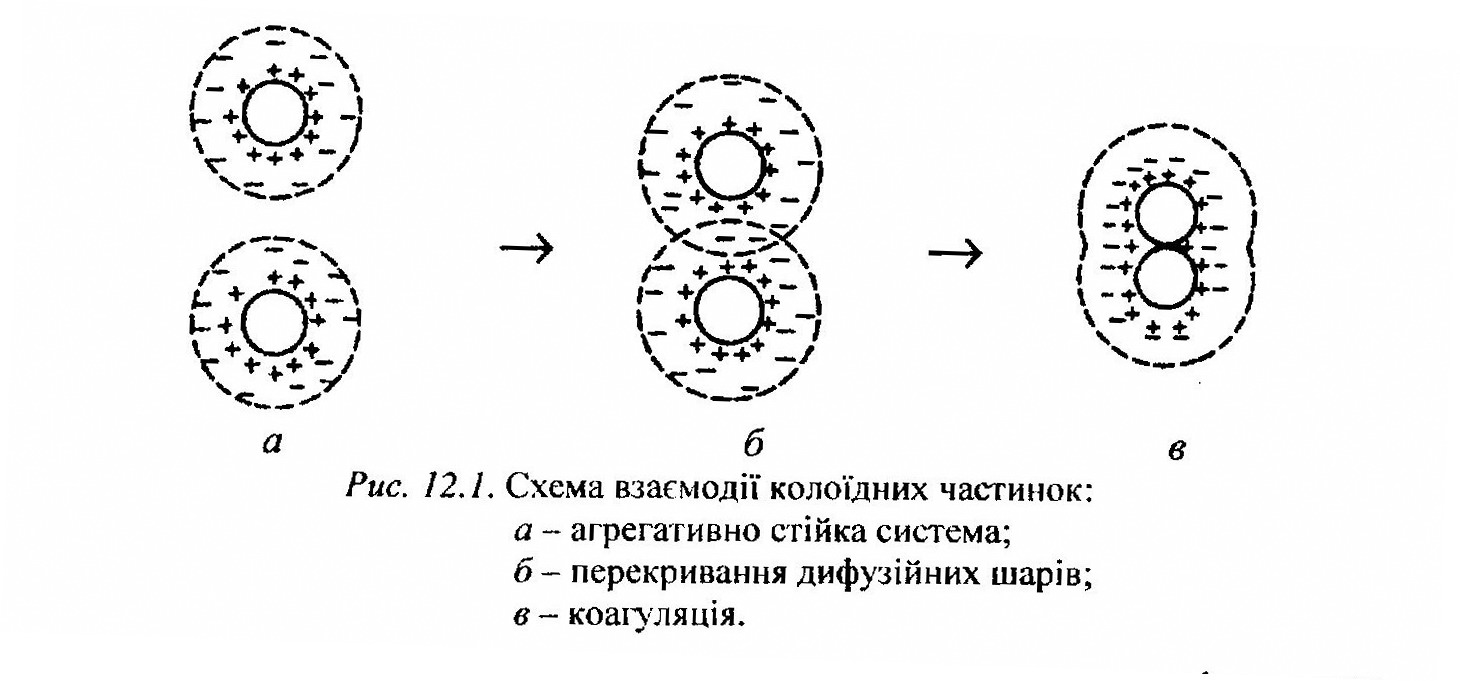
Під коагуляцією розуміють збільшення колоїдних частинок в результаті їх злиття. Коагуляція колоїдів відбувається під впливом факторів, які зменшують електрокінетичний потенціал і тим самим сприяють агрегації колоїдних частинок. Це насамперед введення в колоїдний розчин електролітів, сильне нагрівання чи охолодження, введення колоїдів, які мають протилежний заряд, і навіть глибокий діаліз.
Для початку коагуляції треба, щоб концентрація електролітів була вищою за певну мінімальну величину, яка називається порогом коагуляції (γ)
Дерягін і Ландау показали, що величина порогу коагуляції γ визначається наступним рівнянням:
D3(kT)5
γ = C ------------ (9)
A2e6z6
де С - константа; D - діелектрична стала розчинника; А - константа ван-дер-ваальсівського притягання; е - заряд електрона; z - величина заряду коагулюючого іона, k –коефіціент пропорційності.
Дослідженнями, проведеними Шульце-Гарді (1882-1900) з впливу різних факторів на коагуляцію гідрозолів було виявлено, що іони, які спричиняють коагуляцію, завжди несуть заряд, протилежний заряду колоїдної частинки, і чим вищий заряд іонів, що спричиняють коагуляцію, тобто чим вища їх ступінь окиснення, тим при меншій їх концентрації починається коагуляція (правило Шульце-Гардї).
Наприклад, при додаванні до золю Аs2S3 поріг його коагуляції електролітом КNO3 дорівнює 50 кмоль/м3 (катіон, що спричиняє коагуляцію К+), а електролітом АlCl3 - всього 0,093 кмоль/м3 (катіон, що спричиняє коагуляцію А13+).
Правило Шульце-Гарді має наближений характер, оскільки крім величини заряду іону, що спричиняє коагуляцію, відіграє певну роль його природа, розміри, температура розчину, діелектрична стала розчинника та інші.
В подальшому були запропоновані різні теорії для пояснення закономірностей, які відбуваються при коагуляції. Серед них виділяються два основних механізми коагуляції: концентраційний і нейтралізаційний.
Згідно з концентраційним механізмом коагуляції (Гуї-Чепмен, Штерн) при збільшенні іонної сили розчину відбувається стиснення дифузної частини подвійного електричного шару, що полегшує злипання частинок (коагуляцію). Це однозначно випливає з того , що товщина дифузного шару λ обернено пропорційна півсумі добутків концентрацій іонів на квадрат їх заряду:
 ½
½
1 DT
λ = ------ k ------------ (10)
χ 0,5∑cizi2
χ – відстань від поверхні подвійного електричного шару .
Згідно нейтралізаційного механізму коагуляції зниження електричного потенціалу поверхні відбувається за рахунок адсорбції протиіоніа. Іони з однаковими зарядами мають близькі значення коагулюючої дії і вона зростає зі збільшенням радіуса іона.
Оскільки гідратація іонів зменшується по мірі зростання радіуса іона, то коагулююча дія буде більшою у слабко-гідратованих іонів.
Вплив наведених факторів видно при порівнянні порогів коагулюючої дії одновален-тних катіонів, які розташовуються у ряд
Li+ >Na+ >K+ >Rb+ >Сs+,
а одновалентні аніони розташовані в такий ряд
I->NО3- >Вr- >Сl-.
Ці ряди іонів називаються ліотропними рядами. Така відповідність ліотропним рядам, характерним для іонообмінних процесів, свідчить про адсорбційний механізм коагуляції.
Але наведені теоретичні уявлення не давали можливості пояснити всі процеси, що відбуваються при коагуляції.
8.2 Вплив електролітів на величину електрокінетичного потенціалу. Явище колоїдних частинок. Чергування зон коагуляції. Кінетика коагуляції. Коагуляція золів сумішами електролітів. Взаємна коагуляція золів.
Розглянемо, у чому виявляється коагулююча дія електролітів. Колоїдним системам властива високорозвинута поверхня розділу на межі дисперсна фаза - рідина, що приводить до появи надлишку вільної (міжфазної) енергії. Тому колоїдні системи проявляють тенденцію до адсорбції на їх поверхні іонів або нейтральних частинок (подібних собі). Якщо колоїдна частинка має негативний заряд, то катіони електроліту, введеного в розчин, адсорбуючись на поверхні частинки, частково нейтралізують її заряд. Коли припустити, що адсорбційна здатність введених у розчин катіонів однакова, то молярна кількість адсорбованого однозарядного катіона повинна бути в два рази більшою від двозарядного і в три рази більшою від тризарядного. Коли катіон має велику адсорбційну здатність (наприклад, однозарядний морфін-іон), то його дія як коагулятора значно ефективніша (поріг коагуляції для золя Аs2S3 при додаванні хлориду морфіну дорівнює 0,4 моль/м3).
Основну роль у коагуляції найчастіше відіграє той факт, що збільшення концентрації електролітів зумовлює зменшення товщини дифузного шару, тому що чим більший заряд протиіонів, тим з більшою силою вони притягаються до зарядженої частинки. Чим більше протиіонів буде в адсорбційному шарі, тим тонший дифузний шар і відповідно менший буде електрокінетичний потенціал.
Ступінь коагуляції може бути різною, а сам процес коагуляції на певних стадіях є оборотним. Протягом певного часу збільшення розмірів частинок протікає без будь-яких зовнішніх змін (зміни кольору, скаламутнення, випадання осаду) - це так званий період прихованої коагуляції. Час, що проходить від появи візуально помітних змін у колоїдній системі до випадання осаду, називається періодом явної коагуляції.
Дуже сильний вплив на стійкість і коагуляцію дисперсних систем мають електроліти, що вступають у хімічну взаємодію з протиіонами міцели або стабілізуючим електролітом. Іони введених у колоїдний розчин електролітів можуть утворювати з іонами протилежного знака, що адсорбовані на поверхні колоїдної частинки, малодисоційовані хімічні сполуки. Внаслідок цього зменшується заряд ядра колоїдної частинки. Має значення і природа іонів, у яких заряд однаковий із зарядом ядра. Якщо такі іони добре адсорбуються на поверхні колоїдної частинки, то її заряд збільшуватиметься і відповідно зменшуватиметься коагулююча дія протилежно заряджених іонів.
На стійкість колоїдних розчинів впливає також підвищення температури. З одного боку, це приводить до часткової десорбції іонів з поверхні ядра і до зменшення його заряду, а звідси - і до зменшення електрокінетичного потенціалу. З другого боку, підвищення температури відповідає збільшенню інтенсивності безладного руху молекул і іонів у розчині Розподіл іонів у розчині стає більш рівномірним. Відповідно менша їх кількість залишається в адсорбційному шарі, товщина дифузного шару протиіонів стає більшою. Це повинно привести до збільшення електрокінетичного потенціалу. Таким чином, підвищення температури повинно, з одного боку, привести до зменшення, а з другого, до збільшення електрокінетичного потенціалу. Тому заздалегідь не можна передбачити, як саме підвищення температури впливатиме на коагуляцію. Але практично підвищення температури здебільшого сприяє коагуляції.
Коагуляція золів сумішшю електролітів
Процес коагуляції ускладнюється, якщо застосовують суміш електролітів: відбувається зсув адсорбційної рівноваги, що супроводжується перерозподілом іонів подвійного шару і зміною порогів коагуляції Явища, що спостерігаються при цьому, можна звести до трьох наступних: адитивності, антагонізму і синергізму електролітів.
Якщо електроліти близькі за своєю природою, тоді в суміші електролітів коагулююча дія підсумовується з коагулюючою дією кожного електроліту, і таке явище називається адитивністю іонів. Це означає, що для початку коагуляції можна взяти 100 % граничної концентрації (сг) одного або іншого електроліту або суміш з 50 % граничних концентрацій одного і другого електролітів.
Коли коагулююча дія одного електроліту зменшується при введенні іонів іншого електроліту, говорять про анатагонізм іонів. І навпаки, посилення коагулюючої дії одного електроліту додаванням іншого називається синергізмом іонів.
Описані явища не слід плутати з явищами фізіологічного антагонізму іонів, під яким розуміють послаблення токсичної або фізіологічної дії одного іона, яке викликається іншим іоном. Наприклад, солі Nа+ Zn2+ кожна окремо є отрутою для зародків морської риби Fипdиbиs, але в суміші вони не є отрутою. Очевидно, що явища фізіологічного антагонізму іонів мають більш складну природу.
8.3 Процеси коагуляції під час очищення питної води та стічних вод. Явище звикання золів. Сучасна теорія стійкості і коагуляції гідрофобних золів ДЛФО. Колоїдний захист і його значення для біології, медицини, фармації.
Одним з варіантів коагуляції є взаємна коагуляція різнорідних дисперсних систем - гетерокоагуляція. Взаємна коагуляція спостерігається при змішуванні золів з різнойменне зарядженими частинками. Механізм взаємної коагуляції полягає в тому, що при перекриванні подвійних шарів колоїдних частинок, що мають різні знаки, відбувається не відштовхування, а електростатичне притягання і швидка агрегація частинок. Найбільше повно взаємна коагуляція відбувається тоді, коли заряди колоїдів, протилежні за знаком, рівні між собою.
Якщо поверхні дисперсних фаз систем, що змішуються, мають заряди протилежного знака, то гетерокоагуляція відбувається тим повніше, чим повніше відбудеться нейтралізація зарядів частинок. При змішуванні систем з однойменне зарядженими частинками, як правило, утворюються стійкі змішані системи, але можлива і гетерокоагуляція, яка виникає, наприклад, через перерозподіл стабілізаторів, що приводить до зменшення ступеня стабілізації.
Явище взаємної коагуляції має важливе значення в процесах утворення ґрунтів. Гетерокоагуляція широко використовується в процесах водопід - готовки й очищення стічних вод. Для цього у воду додають мінеральні коагулянти, наприклад солі алюмінію, ферума, магнію, кальцію. Ці солі знижують агрегативну стійкість системи, і частинки забруднюючих речовин випадають в осад. Однак ефективність очищення води від колоїдних дисперсій визначається не тільки зниженням електростатичного бар'єра, а головним чином, гетерокоагуляцією. Солі алюмінію і ферума в результаті реакцій гідролізу утворюють малорозчинні у воді гідроксиди, частинки яких здобувають позитивний заряд:
А13+ + ЗН2О ↔ А1(ОН)3 + ЗН+
Fе3+ + ЗН20 ↔ Fе(ОН)3 + ЗН+
Гідроксиди виділяються переважно на гетерогенних частинках домішок, що також сприяє їх укрупненню.
Коагуляція в деяких випадках залежить від способу додання електроліту коагулятора. Як свідчать експериментальні дані, якщо електроліт додавати до золю невеликими порціями, то в підсумку коагуляція настає при більш високій концентрації електроліту, ніж при внесенні відразу великої його кількості. Таке явище називають звиканням зол/е. Причиною звикання золів може бути утворення пептизатора або адсорбція іонів, заряджених однойменно з частинкою, що приводить до підвищення первісного заряду частинок.
Стійкість ліофобних золів проти коагуляції зростає в присутності ВМО білків, полісахаридів і т.п. Це виявляється у підвищенні значень порогів коагуляції у захищеного золю і відхиленню від правила Шульце-Гарді. Здатність захищати золі від коагуляції кількісно виражають захисним числом.
Захисне число - це кількість міліграмів сухої ВМС, яка запобігає коагуляції 10молів золю при додаванні І молю 10 %-ного розчину NаСІ.
У залежності від природи золю захисне число називають "золотим", якщо воно відноситься до золю золота, "срібним" - для золю срібла,
"залізним" - для золю Fе(ОН)3 тощо. Очевидно, що чим більша величина захисного числа, тим слабкіша захисна дія даної ВМС. Найбільш сильною захисною дією володіють білки: желатин, казеїнат натрію (захисні числа 0,01-0,1), а більш слабкою - крохмаль, декстрин, сапоніни (захисні числа 20-45).
Механізм захисної дії можна пояснити тим, що макромолекули ВМС адсорбуються на поверхні колоїдних частинок, створюючи адсорбційні сольватні шари, що підвищують гідрофільність колоїдних частинок. Внаслідок цього підсилюється взаємодія частинка- розчинник. Сольватні шари забезпечують великий розклинювальний тиск при зближенні двох частинок і перешкоджають їхньому злипанню. Захисна дія підсилюється, якщо в адсорбційному шарі ВМС утворюються гелєподібні структури, які мають підвищену міцність і пружність (це відноситься, наприклад, до желатину).
У ряді випадків спостерігається не підвищення, а зниження стійкості колоїдів при додаванні до них малих кількостей ВМС. Це явище називають сенсибілізацією. Пояснити механізм сенсибілізації можна тим, що при малій концентрації ВМС на частинках утворюється пухкий адсорбційний шар, і частина їх поверхні залишається вільною, що збільшує імовірність адсорбції однієї макромолекули різними її ділянками на двох частинках дисперсної фази. Відбувається коагуляція шляхом "зшивання" частинок.
Надання дисперсним системам агрегативної стійкості здійснюється шляхом зниження схильності частинок дисперсної фази до коагуляції Стабілізація сповільнює осадження (седиментацію) частинок і тим самим підвищує кінетичну стійкість системи. У суспензіях стабілізація дисперсних систем часто супроводжується пептизацією утворених раніше агрегатів. Стабілізація дисперсних систем досягається введенням у дисперсійне середовище так званих стабілізаторів (диспергаторів, емульгаторів, гііно-утворювачів), які, адсорбуючись на поверхні частинок дисперсної фази, змінюють умови їхньої взаємодії із середовищем.
До стабілізаторів відносяться дві групи речовин:
а) неорганічні електроліти;
б) органічні поверхнево-активні речовини (ПАР).
Широке визнання і поширення одержала теорія, що враховує електростатичну складову розклинювального тиску (відштовхування) і його молекулярну складову (притягання). Ця теорія задовільно описує закономірності поводження типово ліофобних дисперсних систем, для яких можна знехтувати адсорбційно-сольватним фактором стійкості.
У найбільш загальному вигляді ця теорія була розроблена КВ.Дерягіним і Л.ДЛандау у 1937-1941 рр. і трохи пізніше незалежно від них голандськими вченими Фервеєм і Овербеком. По перших буквах цих прізвищ ця теорія названа теорією Дерягіна-Ландау-Фервея-Овербека (скорочено ДЛФО).
Згідно цієї теорії між будь-якими частинками при їхньому зближенні виникає розклинювальний тиск поділяючого рідкого прошарку в результаті дії сил притягання і відштовхування. Сили відштовхування, відповідно до теорії ДЛФО, носять електростатичний характер.
Розклинювальний тиск - це тиск, який треба прикласти ззовні (з боку твердих частинок), щоб втримати рівноважну товщину "розклинювального" прошарку.
Він створюється рівнодіючою поверхневих сил. Стан системи залежить від балансу енергії притягання й енергії відштовхування. Перевага енергії притягання викликає порушення агрегативної стійкості, тобто приводить до коагуляції. Ці сили можуть спричинити як відштовхування поверхонь, так і їх притягання і зчеплення. Діють такі сили на досить значній відстані - до сотень нанометрів. Електростатична складова (зумовлена іонно-електроста-тичними силами) має позитивний внесок у розклинювальний тиск при зближенні однойменне заряджених частинок.
8.4 Аерозолі. Методи одержання, властивості, руйнування. Застосування аерозолів в клінічній та санітарно-гігігнічній практиці. Токсична дія деяких аерозолів. Грубо дисперсні системи з рідинним середовищем. Пасти, їх медичне застосування. (СПРС).
Емульсії. Методи одержання та властивості. Типи емульсій. Емульгатори та механізм їх дії. Застосування емульсій у клінічній практиці. Біологічна роль емульгування.
Аерозолі.
Дисперсні системи більш грубої дисперсності, ніж золі, відносять до розряду мікрогетерогенніїх систем. Розмір частинок у таких системах від 10-7 до 10-4 м. У більшості випадків частинки дисперсної фази можна спостерігати в звичайний світловий мікроскоп, тому ці системи і названі мікрогетерогенними.
До мікрогетерогенних систем відносять системи з газоподібним дисперсійним середовищем (аерозолі, порошки) і рідким дисперсійним середовищем (суспензії, емульсії, піни). Для систем з газоподібним дисперсійним середовищем відсутні термодинамічні фактори стійкості, оскільки неможливо створити поверхневий шар з боку газоподібного середовища Властивості систем з рідким дисперсійним середовищем багато в чому визначаються поверхневими явищами - адсорбцією, змочуванням, адгезією. Разом з тим для них характерні свої особливості, вивчення яких становить великий теоретичний і практичний інтерес.
Аерозолями називають вільнодисперсні системи з газоподібним дисперсійним середовищем і дисперсною фазою, що складається з твердих або рідких частинок. Хмари і тумани в атмосфері, а також пов'язані з ними дощ, сніг, гроза - природні явища, які відіграють вирішальну роль у регуляції клімату на планеті Земля. Аерозолі утворюються при вибухах, дробленні і розпиленні речовин, а також у процесах конденсації при охолодженні пересичених парів води й органічних рідик Аерозолі можна одержати і за допомогою хімічних реакцій, що протікають у газовій фазі.
Аерозолі, як правило, агрегативно нестійкі системи, бо взаємодії між поверхнею твердих або рідких частинок і газовим середовищем практично немає. Штучно можна підвищити заряд частинок. На відміну від ліозолів, частинки в аерозолях не мають дифузного шару. Рідкі частинки в туманах мають кулясту форму, тверді частинки в димах і пилу - це кристали, або їх уламки - аморфні утворення різної форми.
За агрегатним станом частинок аерозолі класифікують на тумани (р/г), -дисперсна фаза яких складається з крапельок рідини, дими (т/г) - аерозолі з твердими частинками конденсаційного походження, пил (т/г) - тверді частинки, утворені шляхом диспергування. Можливі системи змішаного типу, коли на твердих частинках конденсується волога Так виникає смог -туман, що утворився на частинках диму. Найбільш високодисперсними аерозолями є дими, розміри твердих частинок яких знаходяться в межах 10-3 - 10-4 нм; частинки пилу мають розміри понад 10 нм, розміри крапельок туманів від 0,1 до 10 нм.
Аерозолі утворюються при механічному подрібненні і розпиленні твердих тіл або рідин, при вибухах, терті твердих тіл тощо. Роль аерозолів у природі, побуті і промисловості надзвичайно велика Наприклад, вплив хмар і туманів на клімат, перенесення вітром насіння і пилку рослин, пневматичні способи фарбування і покриття поверхонь розплавами металів, застосування розпиленого палива (вприскування рідкого палива у двигуни внутрішнього згорання), внесення добрив, для маскування (у військовій справі) тощо. Інсектициди у вигляді аерозолів застосовують для захисту рослин від хвороб і шкідників.
Аерозолі знайшли широке застосування в медицині і фармації Стерильні аерозолі в спеціальних упакуваннях типу балончиків застосовують для стерилізації операційного поля, ран і опіків; інгаляційні аерозолі, що містять антибіотики й інші лікарські речовини, застосовують для лікування дихальних шляхів; аерозолі локального застосування використовують замість перев'язних засобів; аерозолі у вигляді клею - в хірургічній практиці для склеювання ран, шкіри, бронхів, судин тощо.
Водночас, аерозолі відіграють і негативну роль. Утворення аерозолів у вигляді пилу, димів і туманів часто небажано і шкідливо для живих організмів. На металургійних підприємствах у вигляді аерозолів у повітря виходить велика кількість цінних продуктів. Запилення повітря від теплових електростанцій та інших підприємств твердими аерозолями, отруйними туманами негативно впливає на здоров'я людини. Пил, потрапляючи між деталями машин під час їх руху, збільшує спрацювання, знижує коефіцієнт корисної дії. Аерозолі органічних речовин - вугілля, цукру, борошна, паперу- вибухонебезпечні.
Боротьба з димами і промисловим пилом здійснюється за допомогою фільтрації газів через тканинні фільтри, осадження частинок в установках типу циклонів тощо.
Суспензіями називають мікрогетерогенні системи з рідким дисперсійним середовищем і твердою дисперсною фазою і розмірами частинок вище, ніж у колоїдних системах, тобто в діапазоні 10-6 - 10-4 м. Способи одержання і стабілізації суспензій багато в чому подібні з такими для колоїдних розчинів-золів.
Різка відмінність суспензій від колоїдів виявляється в молекулярно-кінетичних і оптичних властивостях. Явища дифузії й осмосу не властиві суспензіям, проходження світла крізь суспензії не викликає опалесценції а спостерігається у вигляді мутності, тому що світлові промені заломлюються і відбиваються частинками суспензії, а не розсіюються.
Седиментаційна стійкість суспензій звичайно дуже мала внаслідок великих розмірів частинок. У суспензіях тверді частинки можуть знаходитися в зваженому стані нетривалий час, осідаючи під дією сили тяжіння. Процесам агрегації частинок у суспензіях сприяють сили притягання різної природи (ван-дер-ваальсівські сили, електростатичні сили, зв'язування частинок макромолекулами довголанцюжкових сполук).
Агрегативна стійкість суспензій є результатом дії сил різної природи, що перешкоджають злипанню частинок:
відштовхування, обумовленого подвійним електричним шаром;
"ентропійного" відштовхування, що виявляється, коли частинки наближаються одна до одної на такі відстані, при яких адсорбовані на них молекули починають зачіпати одна другу;
3) відштовхування, обумовленого сольватними оболонками. Останній вид відштовхування виникає між частинками, якщо на їхній
поверхні адсорбуються молекули розчинника, утворюючи сольватний шар товщиною в один-два молекулярних діаметри. Сольватовані суспензії, що утворюються при цьому, агрегативно стійкі і без спеціальних методів стабілізації.
Стабілізацію суспензій можна здійснювати полімерами. При цьому не тільки підвищується агрегативна стійкість, але і сповільнюється седиментація, тому що підвищується в'язкість дисперсійного середовища.
В аптечній практиці при виготовленні суспензій застосовують тільки механічний спосіб диспергування у рідкому середовищі Диспергування твердих речовин у рідинах відбувається тим легше, чим більша енергія змочування. Гідрофільні речовини (нітрат бісмуту основний, біла глина тощо) легше піддаються диспергуванню у воді, ніж у неполярних рідинах, а гідрофобні речовини (камфора, терпингідрат, сірка тощо), навпаки, у неполярних рідинах.
Якщо до складу суспензії входять сироп, гліцерин, слиз та інші рідини, що підвищують в'язкість дисперсійного середовища, то спочатку розтирання проводять у цих рідинах, а потім вже додають інші прописані у рецепті рідини.
Пасти. Підвищення концентрації дисперсної фази до граничне можливої величини в агрегативно стійких суспензіях приводить до утворення висо-коконцентрованих суспензій, що називаються пастами. Як і вихідні суспензії, пасти агрегативно стійкі в присутності достатньої кількості сильних стабілізаторів, коли частинки дисперсної фази в них добре сольватовані і розділені тонкими плівками рідини, що служить дисперсійним середовищем. Унаслідок малої частки дисперсійного середовища в пастах, уся вона практично зв'язана в сольватних плівках, які розділяють частинки. Відсутність вільної рідкої фази додає таким системам високу в'язкість і деяку механічну міцність. За рахунок численних контактів між частинками в пастах може йти утворення просторових структур і спостерігаються явища тіксотропії.
Найбільш широке застосування отримали зубні пасти.
Основні компоненти зубних паст
Абразивні речовини;
Детергенти (ПАР): раніш використовували мило, зараз лаурилсуль- фат натрію, лаурилсаркозинат натрію, від цього компонента залежить пі нистість зубної пасти і поверхня дотичних речовин.
3) Розріджувачі (гліцерин, поліетиленгліколь) - забезпечують еластич-
ність і в'язкість паст;
4) Зв'язуючі речовини (гідроколоїди, альгінат натрію, крохмаль, густі
соки, декстрин, пектин і т.п.);
5) Різні добавки (екстракти рослин, солі, запашні компоненти і т.п.;
В клінічній практиці розвинутих країн як замінник кісткової тканини застосовується синтетичний гідроксиапатит. Знижуючи чутлив.сть зубІВ, захищаючи поверхневі ділянки емалі, гідроксиапатит має протизапальні властивості, адсорбуючи мікробні тільця, і перешкоджає розвиток гнійно-запальних процесів. Крім цього, гідроксиапатит стимулює ріст кісткової тканини (остеогенез), забезпечує мікрообробку іонами кальцію І фосфору кісткової і зубної тканин, "замуровуючи" мікротріщини в них. Він має високу біосумісність, позбавлений імуногенної й алергійної активності.
Емульсії: методи одержання і властивості
В широкому розумінні емульсіям (від латинського етиlgеrе - "видоювати") називають гетерогенні системи, які утворені з двох рідин, взаємно нерозчинних або мало розчинних, тобто це мікрогетерогенні системи, в яких дисперсна фаза і дисперсійне середовище перебувають у рідкому стані. Одна з цих рідин у вигляді дуже дрібних крапель диспергована в іншій. Першу називають дисперсною фазою, а другу - суцільною або безперервною фазою, або дисперсійним середовищем.
Найбільш поширені емульсії, в яких роль дисперсійного середовища відіграє вода, а роль дисперсної фази - неполярні рідини (жири, мінеральні масла, феноли, толуол та інші). Незалежно від природи неполярної рідини, їх умовно називають одним терміном "олія" і позначають літерою О, а воду позначають літерою В. Дисперсну фазу записують у чисельнику дробу, а дисперсійне середовище - в знаменнику. Так, молоко, що є емульсією вершкового масла у воді, позначають символом О/В, емульсію бензену або толуолу у воді - також символом О/В, емульсію води у нафті або води у вершковому маслі — В/О.
Емульсії виявляють більшою або меншою мірою агрегативну нестійкість. Вільна поверхнева енергія на межі розділення двох фаз зумовлює прагнення системи до довільного зменшення поверхні розділення внаслідок злиття кульок дисперсної фази. Таке злиття краплин називається коалесценцією.
Стійкості концентрованих емульсій можна досягти лише при їх стабілізуванні спеціальними добавками, які називаються емульгаторами. Як емульгатори використовують високомолекулярні (ліофільні колоїди) або поверхнево-активні сполуки, які в своєму складі мають чітко виявлені полярні і аполярні групи.
Так, високомолекулярні сполуки, наприклад білкові молекули, адсорбуються на поверхні краплин подрібненої рідкої фази і утворюють плівкові двовимірні драглі з великою механічною міцністю. Ці двовимірні драглі зв'язані з сольватною оболонкою. При зіткненні двох незахищених кульок легко відбувається коалесценція.
Емульсії можна також класифікувати в залежності від кількісного співвідношення фаз. За цією ознакою розрізняють розведені і концентровані емульсії. Звичайно концентрація розведених емульсій не перевищує 0,1-0,01%; наприклад, якщо збовтати одну краплю олії у 1 л води, або, навпаки, одну краплю води у 1 л олії, то одержимо відносно стійку емульсію без участі будь-яких стабілізаторів (емульгаторів). Головними факторами стійкості таких емульсій є заряд подвійного шару, як і у колоїдних розчинів, а також незначна можливість злиття крапель (коалесценції), оскільки їх зіткнення відбуваються дуже рідко і малоефективні
Якщо ж взяти олію і воду у великих концентраціях, то емульсія може існувати тільки під час сильного збовтування або перемішування Як тільки зупиниться ця фізична дія, рідини зразу ж розділяться на два самостійних шари.
Емульгатори. Речовини, що можуть надавати стійкість емульсіям, тобто які є їх стабілізаторами, називають емульгаторами. Дія емульгаторів викликається тим, що, зосереджуючись на поверхні розділу двох рідких фаз, що утворюють емульсію, вони перешкоджають зворотному злиттю (коалесценції) крапель. Відомі дві групи емульгаторів, механізм дії яких зовсім різний.
До першої групи емульгаторів відносяться поверхнево-активні речовини (ПАР), розчинні в обох фазах емульсій (або в одній з них), які міцно адсорбуються на межі розділу і внаслідок цього знижують міжфазний поверхневий натяг іноді до дуже низьких значень. Ефективними емульгаторами, що стійко (протягом тривалого часу) стабілізують емульсії вже при відносно невеликих концентраціях, є вищі гомологи ПАР - жирні і синтетичні мила, структуровані адсорбційні шари яких мають механічну міцність або підвищену в'язкість. Якщо такі адсорбційні шари утворені не молекулами поверхнево-активної речовини, а їхніми іонами, то стійкість емульсій може бути додатково підвищена електростатичною (відштовхуючою) взаємодією адсорбованих іонів, що, однак, саме по собі сильної стабілізації не викликає.
Другу групу емульгаторів складають тверді високодисперсні мінеральні порошки, частинки яких, наприклад, у водній суспензії, вибірково змочуючись на різних ділянках своєї поверхні обома фазами емульсії; прилипають до міжфазної поверхні розділу і бронюють краплі дисперсної фази. При цьому частинки гідрофільних порошків (глини, каоліни, бентоніти), оксиди, карбонати і сульфати (СаСО3, А12О3, SіО2, ВаSО4 та ін.) також стабілізують емульсії типу "олія у воді". Навпаки, гідрофобні (олеофільні) порошки - сажа, сульфіди важких металів (Рb, Мо, Sn та ін.), карбіди (багаті вуглецем тверді складові частини бітумів і сирої нафти) та інші є емульгаторами зворотних емульсій "вода в олії".
Механізм дії емульгаторів. Для надання агрегативної стійкості емульсіям при звичайних і особливо при високих концентраціях дисперсної фази необхідна їхня стабілізація, що визначається винятково ефективністю дії поверхнево-активних речовин -емульгаторів. Поверхнево-активні речовини, адсорбуючись на поверхні розділу, орієнтуються так, що полярні групи молекул повернуті до полярного розчинника, а неполярні - до неполярної рідини. Внаслідок такої орієнтації на поверхні краплин утворюються двовимірні плівкові кристалоподібні структури. Наявність структури зумовлює пружність і механічну міцність плівок. Приклад - розчин мила у воді. При вдалій консистенції розчину мила можна надути пузирі великих розмірів.
Емульсії дуже поширені в природі і техніці. До них належать, наприклад, молоко, яєчний жовток, тваринні жири типу вершкового масла, маргарин, соус майонез, нафта (в ній завжди міститься в диспергованому стані вода), молочний сік рослин-каучуконосів, емульсії для обробки металів, спеціальні емульсії для знищення комах - шкідників сільського господарства тощо.
У фармації за традицією емульсіями прийнято називати препарати, що відносяться до вищезгаданих систем, які приймаються виключно усередину. Рідкі мазі у вигляді емульсії називають лініментами - від слова linire - "втирати" або lіпітепtит - "втирання", хоча за своїми фізичними властивостями і технології виготовлення вони не відрізняються від емульсій. В той же час деякі з емульсій можна приймати усередину і використовувати як зовнішнє. Тому чіткого поділу на власне емульсії і лініменти не існує. Крім цього, деякі мазі, які містять у своєму складі воду, гідраргірум і інші подібні речовини, за своїми фізико-хімічними властивостями відносяться до емульсій, хоча вони і не рідкі. Таким чином, поняття "емульсія" відноситься до певного фізико-хімічного стану речовини незалежно від методу застосування, лікарського чи технічного призначення.
Фізична та колоїдна хімія
Лекція № 9. Властивості розчинів біополімерів.
Ізоелєктрична точка білка
9.1 Високомолекулярні сполуки - основа живих організмів. Глобулярна та фібрилярна структура білків. Порівняльна характеристика розчинів високомолекулярних сполук, істинних та колоїдних розчинів.
9.2 Набухання та розчинення полімерів. Механізм набухання. Вплив рН середовища, температури та електролітів па набухання. Роль набухання у фізіології організму. Драглювання розчинів ВМС. Механізм драглювання. Вплив рН середовища, температури та електролітів на швидкість драглювання. Тиксотропія. Синерезис. Дифузія в драглях. Висолювання біополімерів з розчинів. Коацервація та її роль у біологічних системах.
9.3 Аномальна в'язкість розчинів ВМС. В'язкість крові. Мембранна рівновага Доннана.
9.4 Ізоелекгричний стан білка. Ізоелєктрична точка та методи її визначення. Йонний стан біополімерів в водних розчинах.
9.5 Значення високомолекулярних сполук (ВМС) у медицині та фармації. (СПРС).
Самостійна робота : Значення високомолекулярних сполук (ВМС) у медицині та фармації.
