
Лабораторна робота № 1
Визначення еквівалентної маси металу
Ціль : визначити, який метал використовували у досліді, використовуючи теоретичні знання про еквівалент; закріпити вміння та навички роботи з хімічним посудом, реактивами та приладами; розвивати вміння складати рівняння хімічних реакцій.
Обладнання та реактиви: 2 вимірювальні бюретки, пробка з газовідвідною трубкою, колба, штатив з двома лапками, трубка для з’єднання бюреток, лійка, наважка металу, загорнутого в маленький шматочок паперу, 3-4 мл. розчину хлоридної або сульфатної кислоти.
Прилади: термометр, барометр.
Техніка безпеки: правила роботи з воднем, зі склом, з кислотами.
Еквівалентом (Е) називається така кількість речовини, яка реагує з 1 молем атомів водню. Маса 1 еквівалента ( me ) називається еквівалентною масою. Еквівалент визначається у молях, еквівалентна маса – у г/моль.
Ме(Н2) = 1 г/моль; me(О2) = 8 г/моль.
Згідно закону еквівалентів маси реагуючих одного з другим речовин m1 та m2 пропорційні їх еквівалентним масам
m1 / m2 = me(1) / me(2) ( 1.1)
Для газоподібних речовин кількість їх виміряється в об’ємних одиницях ( см3, л, м3) і тоді закон еквівалентів можна записати так : об’єми реагуючих речовин V1 і V2 пропорційні їх еквівалентним об’ємам: Ve (1) та Ve(2)
V1 / V2 = Ve (1) / Ve (2) (1.2)
При нормальних умовах (н.у.) мольний об’єм якогось газу дорівнює 22,4 л а еквівалентний об’єм водню Ve (H2) = 22,4 / 2 = 11,2 л.
Для кисню, моль якого вміщує 4 еквівалента, еквівалентний об’єм дорівнює
22,4 /4=5,6 л.
Знаючи, що речовини реагують у еквівалентних співвідношеннях, закон еквівалентів можна математично перетворювати:
m 1/me(1) = m2/me(2)=…=V1/Ve(1)=V2/Ve(2)=V(H2)/11,2=V(O2)/5,6=….. (1.3)
При виконуванні лабораторної роботи вимірювання проводять в умовах, які відрізняються від н.у. Тому, щоб використовувати закон еквівалентів у такому вигляді:
m /me(Me) = V0 (H2) / 11,2 (1.4)
потрібно об’єм витисненого водню ( V(H2) ) привести до н.у.:
P(H2) V(H2) / T = P0 V0 / T0 (1.5)
V0 (H2)= P(H2)V(H2)T0/TP0 = P(H2)V(H2)273/T760=P(H2)V(H2)/T2.78 (1.6)
Таким методом можна визначати еквівалентні маси активних металів, які витискують водень з розчинів розведених кислот.
ДОСЛІД
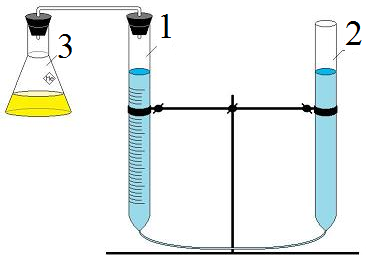 Експеримент
проводиться у приладі (мал.), працюючим
на принципі спілкуючих судин. Одна з
бюреток – вимірювальна. Водень, який
виділяється в наслідок реакції у пробірці
(3), витискує воду у бюретку (2). Підготовка
приладу до роботи включає перевірку
на герметичність, яка заклечається у
тому: якщо пробірку закріпити, закрив
її пробкою, та бюреткою 2 змінить рівень
води у бюретці 1, то у випадку герметичності
приладу при повертанні бюретки 2 у
вихідне становище, відновлюється рівень
води у обох бюретках.
Експеримент
проводиться у приладі (мал.), працюючим
на принципі спілкуючих судин. Одна з
бюреток – вимірювальна. Водень, який
виділяється в наслідок реакції у пробірці
(3), витискує воду у бюретку (2). Підготовка
приладу до роботи включає перевірку
на герметичність, яка заклечається у
тому: якщо пробірку закріпити, закрив
її пробкою, та бюреткою 2 змінить рівень
води у бюретці 1, то у випадку герметичності
приладу при повертанні бюретки 2 у
вихідне становище, відновлюється рівень
води у обох бюретках.
У колбу за допомогою лійки наливають 3-4 мл. розчину хлоридної або сульфатної кислоти.
Наважку металу, зваженого з точністю до 0,001 г та загорнутого в маленький шматочок паперу, розміщують в колбі так, щоб він не торкався кислоти.
Закріпити колбу. Прилад ще раз перевіряємо на герметичність. В журнал записуємо рівень води у бюретці 1 по нижньому меніску води ( V1).
Акуратно струсимо колбу, щоб пакетик з металом упав у кислоту. Спостерігайте за явищами. Напишіть рівняння реакції. Коли метал розчинився зниження води у бюретці 1 – V2.
До лабораторного журналу записуємо показники термометру, барометру та тиск водяних парів, при яких проводили експеримент.
РОЗРАХУНКИ
Oб’є м виділеного водню:
V ( H2) = V2 – V1 (1,7)
Абсолютна температура дослідження:
T = 273 + t0 С (1,8)
Тиск, який чинить водень у приладі :
P(H2) = Pатм - P (H2O) (1,9)
Об’єм виділеного водню при н.у., розраховуємо по формулі(1.6)
Еквівалентну масу металу визначаємо по рівнянню (1.4)
Розраховуємо експериментальну атомну масу металу, валентність якого два :
Амеексп = me(Me) 2 (1,10)
Зрівняємо Аексп з відносними атомними масами металів в Періодичній системі
елементів Д.І.Мендєлеєва і встановити, який це був метал :
А(Ме)експ А(Ме)табл [ Ме] (1,11)
Розраховуємо теоретичну еквівалентну масу даного металу:
meтеор = А(Ме)табл / 2 (1,12)
9.Розрахуємо відносну помилку дослідження:
П = ( mетеорm експ ) 100% / mетеор (1.13)
10.Зробіть висновок про доцільність даного методу у практиці, запишіть
рівняння реакції, яка відповідає виконаному дослідженню.
Контрольні запитання :
Що називається еквівалентом?
Які співвідношення між масами та еквівалентними масами реагуючих одного з другим речовин?
Які метали можна визначати таким методом?
Лабораторна робота № 2
Залежність швидкості реакції від концентрації реагентів
Ціль : визначити закономірності проходження реакції в залежності від концентрації одного із реагуючих речовин, закріпити вміння складати рівняння реакцій, збудувати графік, який підтверджує виконання закону дії мас, закріпити навички та вміння роботи з хімічним посудом, реактивами та приладами.
Обладнання та реактиви: 8 колб або хімічних стаканів, 3 бюретки з розчинами сульфатної кислоти , тіосульфату натрію та дистильованої води.
Прилади: секундомір.
Техніка безпеки: правила роботи зі склом, із сульфатною кислотою.
Вивчання швидкості і механізму хімічних реакцій є головним питанням хімічної кінетики – розділу фізичної хімії.
Знаючи умови проходження реакцій можна змінювати швидкість реакцій, тобто управляти технологічними процесами.
Під швидкістю хімічної реакції розуміють зміни концентрації реагуючих речовин у одиницю часу.
V C / ( C2 – C1 ) / ( 2 – 1 ) (2.1)
де С1 і С2 – концентрації вихідних речовин або продуктів реакції відповідно у момент часу 1 і 2.
При цьому належить памятати про те, що у процесі реакції концентрації вихідних речовин зменшуються, концентрації продуктів збільшуються.
Швидкість хімічної реакції залежить від природи реагуючих речовин і умов проходження реакції, з яких найважливішими є концентрація реагуючих речовин, температура і присутність каталізатора.
На основі експериментального матеріалу норвежські вчені Гульдберг і Вааге та незалежно від них російський вчений Н.Н.Бекєтов у 1867 р. сформулював основний закон хімічної кінетики – закон дії мас : швидкість хімічної реакції прямо прапорціональна добутку концентрацій реагуючих речовин у ступенях рівних стехіометричним коефіцієнтам. Математичний вигляд закону для реакцій типу
aA bB dD fF має вигляд :
V k [ A ]a [ B ]b (2.2)
V – швидкість реакції,
k – константа швидкості,
[A] та [B] – концентрації реагуючих речовин,
a та b – стехіометричні коефіцієнти у рівнянні реакції.
Розглянемо вплив концентрації на прикладі взаємодії тіосульфату натрія на сульфатну кислоту, концентрація якої буде постійна
Na2S2O3 H2SO4 S H2SO3 Na2SO4
При цьму виключимо вплив одного з реагентів, наприклад, сульфатної кислоти. Якісним показником дії реакції може служити помутніння розчину в результаті сірки, яка виділяється.
Згідно закону дії мас :
V k [ H2SO4] [Na2S2O3] (2.3)
Тому якщо [H2SO4]const, то
Vу Kу [Na2S2O3] (2.4)
де Vу – умовна швидкість реакції,
K – умовна константа швидкості реакції,
[Na2S2O3] – відносна концентрація тіосульфату натрія .
В залежності від концентрації тіосульфату натрія час від моменту зливу розчинів до появи видимого осадку сірки буде різним. Так як у даному випадку абсолютне значення зміни концентрації сірки відсутнє. Для спрощення розрахунків умовно приймаємо Су 100, тоді умовну швидкість можливо розрахувати по формулі:
Vy 100 / (2.5)
де - час від моменту зливу розчинів до появи перших ознак помутніння розчину.
Умовна константа швидкості цієї реакції, яка в основному є функцією природи реагуючих речовин і не залежить від концентрації, визначається як:
Ky Vy [ Na 2 S2 O3 ] (2.6)
ДОСЛІД
Пронумеруйте вісім чистих та сухих пробірок:1,2,3,4,1а,2а,3а,4а. У пробірки 1-4 налийте із бюретки по 6мл розчину сульфатної кислоти. У пробірки 1а-4а налийте вказаний у таблиці обєм розчину тіосульфату натрію та дистильованої води, довести їх обєм до 6мл, змінюючи таким чином концентрацію Na2S2O3.
Зливаючи парами вміст пробірок (1 та 1а, 2 та 2а, 3 та 3а, 4 та 4а ), в той же час ввімкніть секундомір та змішавши розчин спостерігайте час появи слабкого помутніння.
Результати занести у табл.:
|
|
№ пробірки 1а 2а 3а 4а |
Об’єм тіосульфату натрія, мл |
Na2S2O3 |
2 3 4 6 |
Об’єм води, мл |
Н2О |
4 3 2 0 |
Відносна концентрація тіосульфату натрія |
[ Na2S2O3 ] |
|
Час протікання хімічної реакції , с |
|
|
Умовна швидкість хімічної реакції |
Vy |
|
Умовна константа швидкості |
Ку |
|
Середнє значення умовної константи швидкості |
Ку(ср.) |
|
РОЗРАХУНКИ
Відносна концентрація тіосульфату натрію визначається по формулі:
[ Na2S2O3 ] V [Na2 S2 O3 ] 6 (2,7)
де V об’єм розчину, вказаний в табл.
Розрахуйте умовну швидкість реакції для кожної пари колб і умовну константу швидкості реакції по формулам (2.5) та (2.6). результати розрахунків внесіть в табл.
За отриманними даними збудуйте графік залежності швидкості реакції ( Vу ) від концентрації реагентів ( тіосульфата натрію ).
Зробіть висновок про те, як швидкість реакції залежить від концентрації реагентів.
Контрольні запитання :
Що розуміють під швидкістю хімічної реакції?
Від чого залежить швидкість хімічної реакції?
Який математичний вигляд має закон діючих мас для даної реакції?
Сформулюйте основний закон хімічної кінетики.
