
КАЗАНСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ МЕТАЛЛОВ
Методические указания к лабораторным работам

Казань 2012
СОДЕРЖАНИЕ ОТЧЕТА
Отчет должен содержать:
- название работы;
- формулировку задания;
- краткое изложение теоретических основ изучаемого вопроса;
- схему экспериментальной установки;
- последовательность выполнения работы: описание аппаратуры и методики экспериментирования и другие пояснения, свидетельствующие о достаточной надежности полученных данных.
- опытные данные. Результаты измерений представляют в виде таблиц. Таблицы должны иметь заголовок, отражающий сущность приводимого в них цифрового материала. Таблицу помещают после первого упоминания о ней в тексте.
Если проводят ряд последовательных измерений какой-либо величины в зависимости от изменений другой, то такие данные, кроме таблицы должны быть представлены в виде графической зависимости.
- расчетные данные с примером расчета.
- выводы по работе. Выводы должны содержать ответы на контрольные вопросы.
Теоретическая часть
Электродный потенциал Е - это напряжение разомкнутой цепи гальванической ячейки, составленной из данного (изучаемого) электрода и условно выбранного электрода сравнения.
Окислительно-восстановительные реакции и адсорбционные процессы, которые протекают на границе раздела двух фаз проводник первого рода - проводник второго рода, приводят к пространственному распределению зарядов и образованию двойного электрического слоя (рисунок 1.1). На поверхности раздела могут присутствовать химически адсорбированные ионы, в данном случае анионы, имеющие тот же знак, что и поверхность металла. Анионы эти частично или полностью дегидратированы, и через их центры проходит внутренняя плоскость Гельмгольца. Внешняя плоскость Гельмгольца проходит через центры электростатически адсорбированных гидратированных (сольватированных) катионов. Большая часть поверхности раздела занята молекулами воды, даже на сильно заряженной поверхности электрода концентрация адсорбированных ионов довольно мала – обычно один ион примерно на 100 А2. В поверхностном слое молекулы растворителя сильно ориентированы, в результате их эффективный дипольный момент довольно велик.
Данная схема наглядно показывает строение двойного электрического слоя, однако к ней нужно относиться не как к абсолютной для всех случаев. Поверхность раздела фаз часто бывает весьма неоднородной. Внутренняя и внешняя плоскости Гельмгольца являются условными плоскостями, характеризующими поверхность раздела с усредненными электрическими свойствами. Если бы удалось измерить локальные потенциалы, то оказалось бы, что они меняются в широких пределах в зависимости от точки измерения, например, вблизи адсорбированного иона или в слое, в котором имеются только молекулы растворителя. Возникающие на границе раздела фаз явления электрод - электролит по-разному влияют на значение электродного потенциала. Так, например, химическая природа металла влияет на значения потенциала электрода в пределе до четырех вольт, состояние поверхности электрода - до десятых вольта, адсорбционные процессы - до десятых или сотых во льта, механические напряжения в металле - до сотых вольта, химическая природа и концентрация электролит; до вольта.

Рисунок 1.1 - Модель двойного электрического слоя: є - диэлектрическая проницаемость воды в зависимости от напряженности электрического поля
Электродные потенциалы разделяются на равновесные (обратимые) и неравновесные (необратимые). Последние часто называют компромиссными или коррозионными.
Если в установлении потенциала принимают участие только собственные ионы металла (заряды переносятся только ими), то такой потенциал называют равновесным, или обратимым. Величина равновесного электродного потенциала зависит от природы металла и растворителя, температуры, активности ионов металла в растворе.
Рассмотрим равновесные электродные потенциалы и механизм их возникновения. Равновесные электродные потенциалы могут возникать как в результате электрохимической реакции, так и без нее. В последнем случае, например, скачок потенциала может определяться ионообменной реакцией. Электроды, на которых устанавливается равновесие в результате электрохимической реакции, подразделяются на электроды первого, второго, третьего рода и окислительно-восстановительные.
Электроды первого рода – металл в контакте с раствором своей соли. Эти электроды являются основой конструкций большинства гальванических элементов.
Можно схематически представить электроды первого рода в виде:
Мz+ М
Равновесный потенциал возникает на таком электроде в результате протекания следующей электрохимической реакции:
Мz+ + ze =М (1.1)
или с участием молекул воды:
Мх + mН2O = Мх-1+ М(Н2O)mz++ zе (1.2)
В соответствии с уравнением (1.1) возникает электрохимическое равновесие между металлом и его ионами в растворе. Ионы, непосредственно определяющие значение электродного потенциала, называются потенциалопределяющими. Значение равновесного потенциала в этом случае определяется по уравнению Нернста для электродов первого рода:
 (1.3)
(1.3)
где Ер - равновесный электродный потенциал металла, В; Е0 - стандартный (равновесный) электродный потенциал металла (потенциал электрода при активности ионов металла в растворе, равной единице и температуре 25°С), R -8,3144 - универсальная газовая постоянная, Дж/Кмоль; Т - температура; оК; z - степень окисления металла при его ионизации (число электронов участвующих в электродной реакции); F = 96500 - постоянная Фарадея, Кл/моль; аm - активность металла (принимается за единицу); аmz+ - активность ионов металла в растворе определяется выражением:
аmz+ = f c v , (1.4)
где с - концентрация электролита, моль/л ; v - количество катионов (ионов металла), образующихся при диссоциации молекулы растворенной соли металла, f - средний коэффициент активности ионов металла (справочная величина). К числу электродов первого рода относятся, например, электроды: Ві3+ Ві ; Сu2+ Сu; Sn2+ Sn; Zn2+| Zn и другие.
Аналогичные по механизму возникновения равновесные электродные потенциалы можно представить следующими уравнениями для амальгамного, водородного и хлорного электродов:
 (1.5)
(1.5)
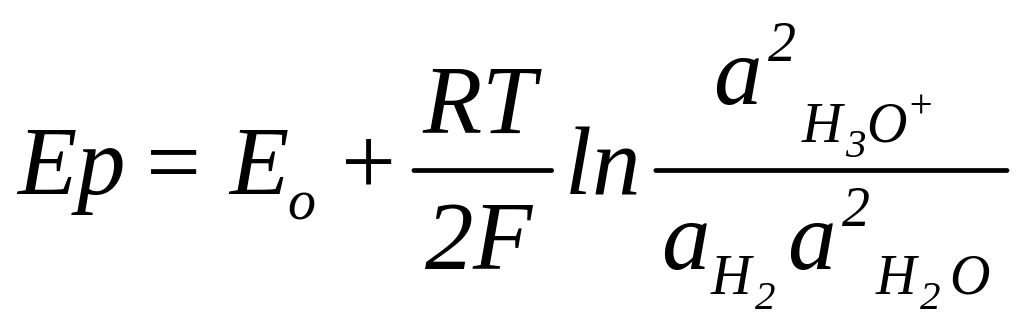 (1.6)
(1.6)
 (1.7)
(1.7)
Из уравнений (1.3),(1.5)-(1.7) следует, что потенциал электрода первого рода зависит от активности лишь определенного вида ионов.
Равновесный электродный потенциал может возникнуть, если металл покрыт слоем его труднорастворимого соединения (соли, оксида или гидроксида) и погружен в раствор, содержащий тот же анион, что и труднорастворимое соединение (электроды второго рода). Электроды второго рода схематически можно представит в виде:
Аz- |МA|М
Электроды второго рода состоят из металла, покрытого слоем его труднорастворимого соединения и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла. Например, хлоридсеребрянный электрод можно представить следующей схемой Сl- |АgСl | Аg. Уравнение для равновесного потенциала хлоридсеребрянного электрода имеет вид:
![]() (1.8)
(1.8)
![]()
Потенциалопределяющей будет реакция:
![]() (1.9)
(1.9)
Другой пример - каломельный электрод, представляющий собой ртуть, покрытую пастой из смеси каломели со ртутью, находящуюся в контакте с раствором хлорида калия Сl- | НgСl2 | Нg. Электродная реакция, в этом случае, сводиться к восстановлению каломели до металлической ртути и аниона хлора по схеме:
![]() -
(1.10)
-
(1.10)
Уравнение для равновесного потенциала имеет вид:
![]() (1.11)
(1.11)
Электроды третьего рода. Равновесный электродный потенциал может возникнуть, если металл погружен в насыщенный раствор своей труднорастворимой соли и малорастворимой соли с тем же анионом, что и труднорастворимая соль (электроды третьего рода). Раствор должен содержать, также хорошо растворимую соль, имеющую общий катион с малорастворимой солью. Например, свинцовый электрод погружен в раствор солей хлорида кальция, оксалата кальция (малорастворимая соль) и оксалата свинца (труднорастворимая соль). Потенциал также выражается уравнением Нернста:
![]() (1.12)
(1.12)
Здесь
![]() (1.13)
(1.13)
где
![]() (1.14)
(1.14)
Подставляя в уравнение (1.12) значения активностей из (1.13) и (1.14), получим :
![]() (1.15)
(1.15)
где
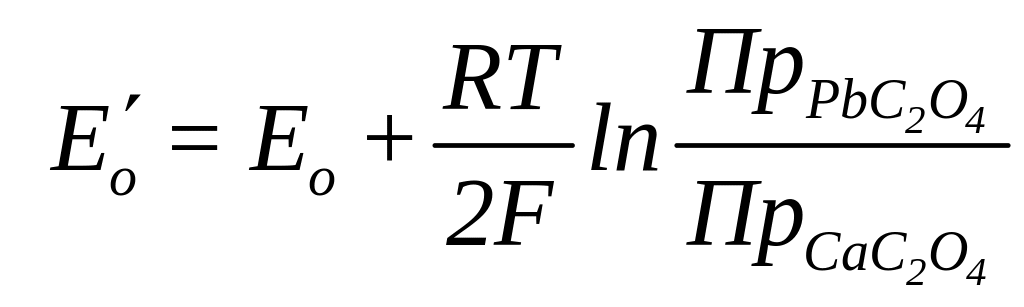
Потенциал такого электрода обратимо реагирует на изменение активности чужеродных катионов.
Равновесный потенциал может иметь место, если индифферентный металл погружен в электролит, содержащий ионы в двух степенях окисления Ох и Red (окисленная и восстановленная форма иона). В этом случае устанавливается равновесие типа:
![]() (1.16)
(1.16)
Для этого случая уравнение Нернста имеет вид:
![]() (1.17)
(1.17)
Возникает такого типа равновесие на так называемых редокси - электродах (окислительно-восстановительные электроды). Однако следует заметить "редокси-электрод", употребляют обычно в тех случаях, когда в электродной реакции не участвуют непосредственные металлы или газы. Металл в редокси-электроде, обмениваясь электронами с участниками окислительно-восстановительной реакции, принимает потенциал, отвечающий установившемуся редокси-равновесию. Если, например, в подкисленном хлоридном растворе имеются ноны и Fе3+ и Fе2+, то в соответствии с равновесием:
![]() (1.18)
(1.18)
потенциал будет определяться уравнением Нернста:
 (
1.19)
(
1.19)
Другие примеры подобных равновесий:
![]() (1.20)
(1.20)
или
![]() (1.21)
(1.21)
Следует различать простые и сложные редокси-электроды. В первом случае электродная реакция сводится к перемене заряда ионов без изменения их состава, например (1.18), (1.20), (1.21).
В сложных редокси-электродах потенциалопределяющая реакция протекает с изменением заряда реагирующих частиц и их состава. В реакциях такого рода участвуют обычно ионы водорода и молекулы воды. При погружении платинового электрода в кислый раствор, содержащий MnSO4 и КМnO4, электродная реакция определяется выражением:
МnО4- + 8Н+ +5е = Мn2+ + 4Н20,
а потенциал электрода – уравнением:
![]()
Для системы хинон - гидрохинон (х , гх) с реакцией
С6Н4О2 + 2Н+ + 2е =С6Н4(ОН)2
потенциал электрода определяется уравнением:

Что касается равновесных потенциалов, которые возникают без протекания электрохимической реакции с переносом электронов, то, как уже отмечалось ранее, скачок потенциала в этом случае возникает в результате ионообменной реакции. Процесс сводится здесь к обмену ионами между мембраной и раствором. Межфазную границу пересекают только те ионы, заряд которых при этом не изменяется, хотя он может быть распределен по-другому между ионами и его новым окружением. При соответствующем подборе состава и структуры мембраны потенциал на межфазной границе будет зависеть от активности только одного какого-либо вида ионов. Такие электроды (ионоселективные) обладают селективностью и позволяют измерять активность отдельных ионов.
Мембраны ионоактивных электродов могут быть твердыми (например, стеклянные или кристаллические) и жидкими (например, хлорбензол, толуол).
Рассмотрим стеклянный электрод, который используется для измерения рН растворов. В стеклах подвижностью обладают лишь низкозарядные катионы, в первую очередь ионы щелочных металлов, а силикатные, алюмосиликатные или иные оксиды образуют практически неподвижную сетку. При возникновении контакта между стеклянной мембраной и раствором начинается обмен ионами между граничащими фазами. Если стеклянный электрод опущен в кислый, нейтральный или слабощелочной раствор, то на границе раздела стекло - раствор происходит реакция обмена ионами водорода между двумя фазами - раствором и стеклом:
Н3O+(p1) = Н3O+(cт), (1.22)
Н3О+(p2) = Н3O+(cт), (1.23)
где р1 - обозначение внутреннего раствора стеклянного электрода (чаще НCl), р2 - обозначение внешнего раствора (раствор с неизвестным значением рН).
В щелочной среде ионообменный процесс идет между ионами щелочного металла М+(ст) в стекле и ионами водорода в растворе:
Н3O+(p) + М+(ст) = Н3O+(cт) + М+(p) (1.24)
Уравнение для потенциала стеклянного электрода можно записать так:
![]() (1.25)
(1.25)
Таким образом, рассмотрены практически все возможные случаи возникновения равновесного потенциала.
Равенство скоростей прямого и обратного процессов отвечает электрохимическому равновесию, характеризующемуся не только балансом вещества, но и балансом электрических зарядов. Скорость реакции обмена, например (1.1), может быть выражена в единицах плотности электрического тока и называется плотностью тока обмена j0 или просто током обмена. Если потенциал электрода равен равновесному, то можно записать следующее выражение:
j0 = jK = jA
Другим классом потенциалов являются неравновесные (необратимые), или компромиссные, потенциалы. Рассмотрим частный случай - коррозионные потенциалы. Коррозия металлов представляет собой случай неравновесных электродных процессов, в то же время ей свойственны некоторые отличительные особенности. Скорость коррозии металла в общем случае определяется скоростями протекания сопряженных электрохимических реакций при коррозионном потенциале:
jкор = jK = jA.

Рисунок 1.2 - Коррозия железа при контакте с водой (случай электрохимической коррозии)
Рассмотрим в качестве примера процесс коррозии железа (рисунок 1.2). Как правило, поверхность железной пластины из технического металла неоднородна как физически, так и химически (наличие примесей). В результате неоднородности на поверхности железа имеются участки, обладающие относительно раствора разными потенциалами. Таким образом, некоторые участки поверхности железа служат анодом, на которых происходит окисление (ионизация) железа:
Fе - 2е = Fе2+, Е0 = -0,441В (1.27)
или
Fе = Fе2+ + 2e
Образующиеся при этом электроны переходят по металлу к другим участкам поверхности, которые играют роль катода. На них происходит реакции восстановления. В зависимости от коррозионной среды восстановление кислорода можно представить как:
О2 +4H3O+ +4е = 6Н2О; Е0 = 1,229 В (1.28)
(кислая среда)
или
О2+2H2О + 4e = 4ОН-; Е0=0,401В (1.29)
(щелочная среда)
Такой процесс называется коррозией с кислородной деполяризацией. При восстановлении ионов гидроксония (или воды) процесс называется коррозией с водородной деполяризацией. Электрохимические реакции в данном случае можно представить уравнениями:
2Н3О+ + 2е = Н2 + 2Н2О; Ео = 0,0В (1.30)
(кислая среда)
или
2Н2О + 2е = 2ОН- +Н2 ; Е0 = - 0,828В (1.31)
(щелочная среда)
Коррозионный потенциал, несмотря на необратимость процесса коррозии, может быть иногда устойчив в течение длительного времени. Установившееся постоянное значение потенциала не обязательно свидетельствует о достижении равновесного состояния. Оно указывает лишь на то, что суммарное число зарядов, переходящих через границу в одном направлении, равно суммарному числу зарядов, пересекающих ее в обратном направлении. В тех случаях, когда значение коррозионного потенциала близко к равновесному потенциалу одной из сопряженных реакций, скорость коррозии металла может быть вычислена путем подстановки выражения равновесного потенциала в уравнение плотности тока коррозии. В других случаях коррозионные потенциалы не соответствуют уравнению Нернста (1.3).
Рассмотренные примеры возникновения электродных потенциалов базируются на чисто ионной концепции. Другими словами, в случае контакта металла и раствора принимается, что в каждой из этих фаз присутствуют ионы, тогда как электроны не могут находиться в растворе. Такая чисто ионная концепция приводила, однако, к невозможности истолкования ряда проблем, связанных с возникновением э.д.с. в электрохимических системах и с поведением металлов, находящихся в контакте с растворами, содержащими их ионами. В настоящие время получены экспериментальные данные, которые свидетельствуют о том, что при рассмотрении равновесия между металлом и раствором недостаточно учитывать лишь распределение ионов между ними, необходимо принимать во внимание и распределение электронов (ионно-электронное равновесие). Относительная роль электронов в установлении электродного равновесия и значение его потенциала зависят от устойчивости продуктов их взаимодействия, т.е. от устойчивости сольватированных электронов в растворе. Концепция ионно-электронного равновесия является более общей, чем концепция ионного равновесия, и в ряде случаев позволяет объяснить закономерности электродного равновесия.
