
- •Лекция 1 Введение
- •1 Основные понятия химии
- •Где м(х) – мольная масса вещества х, fэкв.(х) – фактор эквивалентности вещества х.
- •2 Основные законы химии
- •1) Массы реагирующих веществ – прямо пропорциональны молярным массам эквивалентов этих веществ:
- •2) Объемы реагирующих веществ – обратно пропорциональны их нормальным концентрациям:
- •Лекция 2 основные классы неорганических соединений
- •1 Простые вещества
- •2 Сложные вещества
- •«Растворы»
- •Лекция №3
- •«Общие свойства растворов»
- •1 Классификация систем, состоящих из двух и более веществ
- •Дисперсные системы
- •Коллоидные растворы
- •3 Истинные растворы
- •2 Способы выражения состава растворов
- •1) Массовая доля (ω) – отношение массы растворенного вещества к массе раствора
- •3) Равномерное распределение сольватов (гидратов) в растворителе. Является следствием диффузии и требует затраты энергии.
- •4 Растворимость
- •4.1 Растворимость газов в жидкостях. Закон Генри
- •4.2 Растворимость твердых веществ в воде
- •Лекция № 4 «растворы неэлектролитов»
- •1 Свойства растворов неэлектролитов
- •2) Растворенное вещество – нелетучее и не диссоциирующее на ионы.
- •1.2 Криоскопический и эбуллиоскопический законы Рауля
- •- Криоскопический закон, - эбуллиоскопический закон,
- •2 Осмос
- •3 Применение законов Рауля и уравнения Вант-Гоффа к растворам электролитов
- •Лекция № 5 «растворы электролитов»
- •1 Электролитическая диссоциация
- •1.2 Диссоциация слабых электролитов
- •2 Закон разбавления Оствальда
- •3 PH водных растворов
- •3.1 Ионное произведение воды
- •Ионно-обменные и окислительно-восстановительные реакции
- •Лекция № 6
- •«Ионно-обменные реакции»
- •3) Образование осадков
- •4) Образование комплексных соединений
- •3 Гетерогенные равновесия в растворах электролитов.
- •Лекция № 7 «Гидролиз солей»
- •1 Общие представления о гидролизе
- •2 Различные случаи гидролиза
- •1) Гидролиз соли образованной слабым основанием и сильной кислотой
- •4) Гидролиз солей, образованных многозарядными катионами и анионами
- •5) Совместный гидролиз двух солей, образованных слабой кислотой и слабым основанием
- •5 Смещение равновесия при гидролизе
- •5.1 Влияние добавок различных веществ на гидролиз
- •5.2 Влияние температуры на смещение гидролиза
- •5.3 Влияние концентрации гидролизующейся соли
- •Лекция № 8 «окислительно-восстановительные реакции»
- •1 Основные понятия
- •5 Взаимодействие металлов с водой, кислотами и щелочами
- •Электрохимические процессы
- •Лекция №9
- •«Гальванические элементы»
- •1 Электродный потенциал на границе металл – раствор
- •2 Принцип работы гальванического элемента
- •3 Водородный электрод сравнения. Электрохимический ряд
- •4 Уравнение Нернста
- •96500 Кл/моль),
- •5 Элементы
- •Лекция № 10 «электролиз»
- •3 Количественные расчёты в электролизе
- •4 Аккумуляторы
- •1) Свинцовый аккумулятор
- •2) Кадмиево-никелевый аккумулятор (кн)
- •3) Железо-никелевый аккумулятор (жн)
- •Лекция № 11 «коррозия и защита металлов от коррозии»
- •2.2 Гальванокоррозия
- •1) Гальванокоррозия чугуна в нейтральной среде:
- •2) Гальванокоррозия чугуна в кислой среде:
- •3) Контактная коррозия железа и меди в нейтральной среде.
- •2.3 Электрокоррозия
- •3 Способы защиты металлов от коррозии
- •3.1 Изолирование металлов от внешней среды
- •1) Гальванокоррозия оцинкованного железа в нейтральной среде
- •2) Гальванокоррозия луженого железа в кислой среде
- •3.2 Изменение состава коррозионной среды
- •3.3 Рациональное конструирование
- •3.4 Электрохимические способы защиты от коррозии
- •1) Протекторная защита.
- •2) Катодная защита.
- •Тема 5 основные закономерности протекания химических процессв лекция № 12
- •1 Энергетика химических процессов.
- •2 Закон Гесса
- •Или через промежуточный продукт (со) в две реакции:
- •1) Реакция горения этана выражается термохимическим уравнением
- •2) Рассчитать количество тепла, необходимое для испарения 1 м3 воды.
- •9.3 Энтропия
- •9.4 Энергия Гиббса
- •Лекция № 13
- •Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •1 Скорость реакции
- •1. История развития учения о строении атома
- •1.1. Модель атома по резерфорду
- •1.2. Модель атома по бору
- •1) Электрон в атоме может вращаться вокруг ядра не по любым, а только по строго определённым орбитам, которые называются стационарными.
- •2) Двигаясь по стационарным орбитам, электрон не излучает энергию.
- •1) Была неприменима для описания спектров атомов более сложных, чем водород;
- •2) Не могла объяснить различной интенсивности спектральных линий в спектре даже атома водорода.
- •1.3. Современные представления об атоме
- •2. Квантово–механическая модель атома
- •2.1. Квантовые числа
- •2.4. Соответствие электронных формул элементов и положением их в периодической таблице
- •3. Периодический закон и периодическая таблица д.И.Менделеева
- •3.1. Периодический закон
- •3.3 Периодичность изменения свойств элементов в периодической таблице
- •3.3.1 Радиусы атомов в периодах радиусы атомов по мере увеличения заряда ядра уменьшаются вследствие увеличения электростатического взаимодействия электронов с ядром.
- •3.3. 6 Прогнозирование свойств элементов по положению в периодической таблице
- •Лекция № 15 «Химическая связь, строение молекул и строение вещества»
- •2. Метод валентных связей
- •1) Обменный – два атома предоставляют по одному электрону на образование общей электронной пары.
- •2) Донорно-акцепторный – один атом (донор) предоставляет электронную пару, а второй (акцептор) – свободную орбиталь.
- •3. Основные характеристики химической связи
- •4. Типы химических связей
- •4.1.Ковалентная связь – это связь между двумя атомами за счет образования общей электронной пары.
- •4.3. Металлическая связь
- •4.4. Водородная связь
- •5. Строение гидридов элементов II-периода
- •Химия элементов
- •Лекция № 16
- •«Свойства s-элементов»
- •1. Щелочные металлы
- •2. Бериллий, магний и щелочноземельные металлы
- •3. Химические свойства s-элементов
- •4. Физико–химические свойства водорода и гелия
- •5. Физико–химические свойства воды
- •5.2. Физические свойства воды
- •5.3. Химические свойства воды
- •Лекция № 17 «жесткость воды»
- •1. Общие понятия
- •3. Единица измерения жесткости
- •4. Водоподготовка
- •5. Водоумягчение
- •1.3. Алюминий
- •1.4. Индий. Галлий. Таллий
- •2.1. Электронное строение и общая характеристика
- •2.2. Углерод и его соединения
- •2.3. Кремний
- •2.4. Германий. Олово. Свинец
- •Лекция № 19 «свойства р-элементов
- •V и VI групп»
- •1.1. Электронное строение и общая характеристика
- •1.2. Азот
- •1.3. Фосфор
- •1.4. Мышьяк, сурьма, висмут
- •2.1. Введение
- •2.2. Кислород
- •2.3. Сера
- •2.4. Сравнение свойств водородных соединений р-элементов VI группы
- •2.5. Селен. Теллур
- •Лекция № 20
- •1.1. Электронное строение и общая характеристика VII группы (галогены)
- •Галогены проявляют нечетные валентности
- •1.2 Физические свойства галогенов
- •1.3 Химические свойства галогенов
- •1.4 Водородные соединения галогенов
- •1 .5 Кислородсодержащие соединения галогенов
- •1.6 Применение галогенов
- •1.7 Положение в периодической таблице и общая характеристика р-элементов VIII группы
- •Лекция № 21
- •1. Определение комплексных соединений
- •1) Диссоциация сульфатов калия и алюминия
- •2) Дисоциация двойной соли – алюмокалиевых квасцов
- •3)Диссоциация комплексного соединения
- •2. Состав комплексных соединений
- •1) Комплексный ион – [Fe(сn)6]-3,
- •Примеры состава комплексных соединений
- •3. Номенклатура комплексных соединений
- •[Pt(nh3)4Cl2]Cl2 –хлорид дихлоротетраамминплатины (IV)
- •4. Диссоциация комплексных соединений
- •5. Реакции с участием комплексных соединений
- •5.1. Образование комплексных соединений
- •5.2. Преход от одного комплексного соединения к другому
- •5.3 Разрушение комплексного соединения
- •Лекция № 22
- •Введение
- •1.1. Физические свойства
- •1.2. Химические свойства
- •Вопрос № 3 Составьте уравнения реакций, протекающих при осуществлении следующих превращений Cu→Cu(no3)2→Cu(oh)2 →CuSo4.
- •Лекция № 23
- •Лекция № 24
- •2.1 Элементы триады железа
- •2.2 Платиновые металлы
- •Лекция 25 «органические соединения» введение
- •1) Замещения атомов водорода по связям с с–н,
- •2) Разрыва связей с–с.
- •1.2. Непредельные (ненасыщенные) углеводороды
- •Ацетилен с2н2, или сн±сн
- •3.3. Простые эфиры
- •3.4. Альдегиды и кетоны
- •3.5. Карбоновые кислоты
- •3.6. Сложные эфиры карбоновых кислот. Жиры
- •3.7. Амины
- •3.8. Аминокислоты и белки
- •Лекция № 26 «полимеры» Введение
- •3.Поликонденсеционные полимеры
- •4. Структура и состояния полимеров
- •Лекция № 27 «рабочие вещества низкотемпературной техники» Введение
- •1 Моль co2 – 6·1023 молекул co2 – 44г – 22,4л(н.У.).
- •1.Хладагентынеорганического происхождения
- •1.1. Номенклатура неорганических хладагентов
- •1.2. Физические и химические свойства неорганических хладагентов
- •2. Хладагенты органического происхождения (углеводороды)
- •2.1. Строение и номенклатура
- •2.2. Физические и химические свойства
- •3. Хладагенты органического происхождения (галогенпроизводные)
- •3.2.Цепные реакции(пределы взрываемости, разрушение озонового слоя)
2.1 Элементы триады железа
В триаду железа входят: железо(Fе), кобальт (Со) и никель(Ni). Это основные конструкционные металлы.Электронные конфигурация данных атомов имеют соответственно вид: 3d64s2. 3d74s2. 3d84s2. Наиболее устойчивые степени окисления для железа +2, +3 и +6, а для кобальта и никеля +2, +3.
Для железа наиболее устойчива при обычных условиях степень окисления +3, поэтому соединения железа +2 являются сильными восстановителями, а +6 – сильными окислителями. Для кобальта и никеля наиболее устойчива степень окисления+2, а в степени окисления +3 они обладают сильными окислительными свойствами.
В таблице 2 приведены основные классы соединений, образуемых железом.
Таблица 2. Основные классы соединений железа
|
+2 |
+3 |
+6 |
Оксиды |
FеО (основной)
оксид железа (II) |
Fе2О3 (амфотерный)
оксид железа (III) |
FеО3 (кислотный)
оксид железа (VI)
|
FеО + Fе2О3 = Fe3О4 смешанный оксид |
|||
Гидроксиды |
Fе(ОН)2
гидроксид железа (II)
|
Fе(ОН)3
гидроксид железа (III)
НFеО2 мета-железистая кислота
Н3FеО3 орто-железистая кислота |
Н2FеО4 железная кислота
Н
Н–О О |
Соли |
FеСl2 хлорид железа (II)
|
FеСl3 хлорид железа (III)
К3СrО3 – феррит калия |
К2FеО4 феррат калия
|
На примере железа в таблицы 24.1 приведен системный анализ основных классов неорганических соединений.
Железо, кобальт и никель - активные металлы, находящийся в ряду напряжений до водорода. На воздухе окисляются с образованием соответствующих оксидов. Накаленное железо сгорает по реакции
4Fe + 3О2 = Fe2О3.
В мелкораздробленном состоянии (диаметр частиц около 5мкм) самовоспламеняются на воздухе, т.е. обладают пирофорными свойствами.
Железо при температуре красного каления (~500 0С) окисляется водой
3Fe + 4Н2О = Fe2О3 + H2.
Оксид железа (II) FeO и соответствующий ему гидроксид Fe(OH)2 обладают основными свойствами; оксид железа (III) Fe2О3 проявляет амфотерные свойства растворяется в кислотах, а при сплавлении со щелочами образует соли железистой кислоты - метаферриты:
Fe2О3 + 6 НС1 = 2 FeCl3 + 3 Н2О;
Fe2О3 + 2 NaOH = 2NaFeО2 + H2О .
Смешанный оксид железа (II, III) – Fe3О4 можно рассматривать как соль, образованную при взаимодействии основного оксида (FeO) и амфотерного оксида(Fe2О3) с образованием соли Fe(FeО2)2 - метаферрит железа (II). Структурную формулу данной соли можно представить следующим образом
О – Fe
= О
– Fe
= О
 Fe
Fe
О – Fe = О
Соединения железа (II) проявляют восстановительные свойства и легко окисляются до соединений железа (III). Например, белый гидроксид железа (II) уже в момент осаждения из растворов принимает зеленоватую окраску вследствие частичного окисления кислородом воздуха, а затем зелёный цвет изменяется на бурый в результате полного окисления Fe(OH)2 до Fe(OH)3
4 Fe(OH)2 + O2 + 2 Н2О = 4 Fe(OH)3.
Данная реакция используется для обезжелезивания воды.
Соляная и разбавленная серная кислоты растворяют данные металлы с образованием двухвалентных солей
Fe + 2НCl = FeCl2 + Н2.
При растворении железа в азотной или концентрированной серной кислотах при обычных условиях или при нагревании образуются соли железа (III):
Fe + 4НNO3(разб.) → Fe(NO3)3 + NO + 2Н2О,
2 Fe + 6 H2SО4 = Fe2(SО4)3 + 3 SО2↑ + 6 H2О.
Концентрированная азотная кислота, содержанная NO2, и концентрированная (близкая к 100%) серная кислота пассивирует данные металлы, создавая на их поверхности оксидные пленки.
Ионы Fe3+ проявляют относительно сильные окислительные свойства φ°(Fe3+/ Fe2+) = +0,77 В. На практике это используется для «травления» печатных плат по реакции:
2 FeCl3 + Сu = 2 FeCl2 + CuCl2.
Ионы Fe2+ и Fe3+ - являются комплексообразователи. Наиболее устойчивы цианидные комплексы:
1) К4[Fе(СN)6] – гексацианоферрат (II) калия («жёлтая кровяная соль») является чувствительным реактивом на ионы Fе3+
FeCl3 + K4[Fe(СN)6] → KFe[Fe(СN)6] + KCI.
Образующийся малорастворимый гексацианоферрат(П) калия-железа(Ш) имеет интенсивно синий цвет. Это соединение часто называют «берлинской лазурью».
2) Кз[Fе(СN)6] – гексацианоферрат(III) калия («красная кровяная соль») является чувствительным реактивом на ионы Fе2+
FeCl2 + K3[Fe(СN)6] → KFe[Fe(СN)6] + 2KCI.
Образующийся осадок гексацианоферрат(Ш) калия-железа(И) окрашен в интенсивно синий цвет; его часто называют «турнбулевой синью».
Соединения железа (VI) - ферраты - очень сильные окислители
2 K2FeО4 + 16 НС1 = 2 FeCl3 + 3 Cl2↑ + 4 KCI + 8 H2О.
Качественной реакцией на трехвалентное железо является взаимодействие его с роданидом калия или аммония
FeCl3 + 3 KCNS Fe(CNS)3 + 3 KCl.
Железо образует с СО летучую жидкость пентакарбонил железа Fe(СО)5, которая при нагревании разлагается на СО и порошкообразное высокочистое железо.
При обработке поверхности железа азотом (азотировании) оно приобретает твердость и коррозионную стойкость. С углеродом железо образует прочное соединение цементит Fe3С. Большое практическое значение имеют соединения железа, кобальта и никеля с кремнием и бором, которые придают сплавам: твердость, прочность при высокой температуре и коррозионную стойкость.
Соли кобальта (II) в безводном состоянии обычно синего цвета, а их водные растворы и кристаллогидраты имеют розовую окраску. Фильтровальная бумага, пропитанная раствором хлорида кобальта(II) и затем высушенная, может служить грубым гигрометром (указателем влажности), так как в зависимости от содержания влаги в воздухе он принимает разные оттенки цветов от синего до розового. Соединения никеля сходны с соединениями кобальта.


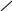
 –О
О
–О
О
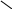
 Fе
Fе