
- •Лекция 1 Введение
- •1 Основные понятия химии
- •Где м(х) – мольная масса вещества х, fэкв.(х) – фактор эквивалентности вещества х.
- •2 Основные законы химии
- •1) Массы реагирующих веществ – прямо пропорциональны молярным массам эквивалентов этих веществ:
- •2) Объемы реагирующих веществ – обратно пропорциональны их нормальным концентрациям:
- •Лекция 2 основные классы неорганических соединений
- •1 Простые вещества
- •2 Сложные вещества
- •«Растворы»
- •Лекция №3
- •«Общие свойства растворов»
- •1 Классификация систем, состоящих из двух и более веществ
- •Дисперсные системы
- •Коллоидные растворы
- •3 Истинные растворы
- •2 Способы выражения состава растворов
- •1) Массовая доля (ω) – отношение массы растворенного вещества к массе раствора
- •3) Равномерное распределение сольватов (гидратов) в растворителе. Является следствием диффузии и требует затраты энергии.
- •4 Растворимость
- •4.1 Растворимость газов в жидкостях. Закон Генри
- •4.2 Растворимость твердых веществ в воде
- •Лекция № 4 «растворы неэлектролитов»
- •1 Свойства растворов неэлектролитов
- •2) Растворенное вещество – нелетучее и не диссоциирующее на ионы.
- •1.2 Криоскопический и эбуллиоскопический законы Рауля
- •- Криоскопический закон, - эбуллиоскопический закон,
- •2 Осмос
- •3 Применение законов Рауля и уравнения Вант-Гоффа к растворам электролитов
- •Лекция № 5 «растворы электролитов»
- •1 Электролитическая диссоциация
- •1.2 Диссоциация слабых электролитов
- •2 Закон разбавления Оствальда
- •3 PH водных растворов
- •3.1 Ионное произведение воды
- •Ионно-обменные и окислительно-восстановительные реакции
- •Лекция № 6
- •«Ионно-обменные реакции»
- •3) Образование осадков
- •4) Образование комплексных соединений
- •3 Гетерогенные равновесия в растворах электролитов.
- •Лекция № 7 «Гидролиз солей»
- •1 Общие представления о гидролизе
- •2 Различные случаи гидролиза
- •1) Гидролиз соли образованной слабым основанием и сильной кислотой
- •4) Гидролиз солей, образованных многозарядными катионами и анионами
- •5) Совместный гидролиз двух солей, образованных слабой кислотой и слабым основанием
- •5 Смещение равновесия при гидролизе
- •5.1 Влияние добавок различных веществ на гидролиз
- •5.2 Влияние температуры на смещение гидролиза
- •5.3 Влияние концентрации гидролизующейся соли
- •Лекция № 8 «окислительно-восстановительные реакции»
- •1 Основные понятия
- •5 Взаимодействие металлов с водой, кислотами и щелочами
- •Электрохимические процессы
- •Лекция №9
- •«Гальванические элементы»
- •1 Электродный потенциал на границе металл – раствор
- •2 Принцип работы гальванического элемента
- •3 Водородный электрод сравнения. Электрохимический ряд
- •4 Уравнение Нернста
- •96500 Кл/моль),
- •5 Элементы
- •Лекция № 10 «электролиз»
- •3 Количественные расчёты в электролизе
- •4 Аккумуляторы
- •1) Свинцовый аккумулятор
- •2) Кадмиево-никелевый аккумулятор (кн)
- •3) Железо-никелевый аккумулятор (жн)
- •Лекция № 11 «коррозия и защита металлов от коррозии»
- •2.2 Гальванокоррозия
- •1) Гальванокоррозия чугуна в нейтральной среде:
- •2) Гальванокоррозия чугуна в кислой среде:
- •3) Контактная коррозия железа и меди в нейтральной среде.
- •2.3 Электрокоррозия
- •3 Способы защиты металлов от коррозии
- •3.1 Изолирование металлов от внешней среды
- •1) Гальванокоррозия оцинкованного железа в нейтральной среде
- •2) Гальванокоррозия луженого железа в кислой среде
- •3.2 Изменение состава коррозионной среды
- •3.3 Рациональное конструирование
- •3.4 Электрохимические способы защиты от коррозии
- •1) Протекторная защита.
- •2) Катодная защита.
- •Тема 5 основные закономерности протекания химических процессв лекция № 12
- •1 Энергетика химических процессов.
- •2 Закон Гесса
- •Или через промежуточный продукт (со) в две реакции:
- •1) Реакция горения этана выражается термохимическим уравнением
- •2) Рассчитать количество тепла, необходимое для испарения 1 м3 воды.
- •9.3 Энтропия
- •9.4 Энергия Гиббса
- •Лекция № 13
- •Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •1 Скорость реакции
- •1. История развития учения о строении атома
- •1.1. Модель атома по резерфорду
- •1.2. Модель атома по бору
- •1) Электрон в атоме может вращаться вокруг ядра не по любым, а только по строго определённым орбитам, которые называются стационарными.
- •2) Двигаясь по стационарным орбитам, электрон не излучает энергию.
- •1) Была неприменима для описания спектров атомов более сложных, чем водород;
- •2) Не могла объяснить различной интенсивности спектральных линий в спектре даже атома водорода.
- •1.3. Современные представления об атоме
- •2. Квантово–механическая модель атома
- •2.1. Квантовые числа
- •2.4. Соответствие электронных формул элементов и положением их в периодической таблице
- •3. Периодический закон и периодическая таблица д.И.Менделеева
- •3.1. Периодический закон
- •3.3 Периодичность изменения свойств элементов в периодической таблице
- •3.3.1 Радиусы атомов в периодах радиусы атомов по мере увеличения заряда ядра уменьшаются вследствие увеличения электростатического взаимодействия электронов с ядром.
- •3.3. 6 Прогнозирование свойств элементов по положению в периодической таблице
- •Лекция № 15 «Химическая связь, строение молекул и строение вещества»
- •2. Метод валентных связей
- •1) Обменный – два атома предоставляют по одному электрону на образование общей электронной пары.
- •2) Донорно-акцепторный – один атом (донор) предоставляет электронную пару, а второй (акцептор) – свободную орбиталь.
- •3. Основные характеристики химической связи
- •4. Типы химических связей
- •4.1.Ковалентная связь – это связь между двумя атомами за счет образования общей электронной пары.
- •4.3. Металлическая связь
- •4.4. Водородная связь
- •5. Строение гидридов элементов II-периода
- •Химия элементов
- •Лекция № 16
- •«Свойства s-элементов»
- •1. Щелочные металлы
- •2. Бериллий, магний и щелочноземельные металлы
- •3. Химические свойства s-элементов
- •4. Физико–химические свойства водорода и гелия
- •5. Физико–химические свойства воды
- •5.2. Физические свойства воды
- •5.3. Химические свойства воды
- •Лекция № 17 «жесткость воды»
- •1. Общие понятия
- •3. Единица измерения жесткости
- •4. Водоподготовка
- •5. Водоумягчение
- •1.3. Алюминий
- •1.4. Индий. Галлий. Таллий
- •2.1. Электронное строение и общая характеристика
- •2.2. Углерод и его соединения
- •2.3. Кремний
- •2.4. Германий. Олово. Свинец
- •Лекция № 19 «свойства р-элементов
- •V и VI групп»
- •1.1. Электронное строение и общая характеристика
- •1.2. Азот
- •1.3. Фосфор
- •1.4. Мышьяк, сурьма, висмут
- •2.1. Введение
- •2.2. Кислород
- •2.3. Сера
- •2.4. Сравнение свойств водородных соединений р-элементов VI группы
- •2.5. Селен. Теллур
- •Лекция № 20
- •1.1. Электронное строение и общая характеристика VII группы (галогены)
- •Галогены проявляют нечетные валентности
- •1.2 Физические свойства галогенов
- •1.3 Химические свойства галогенов
- •1.4 Водородные соединения галогенов
- •1 .5 Кислородсодержащие соединения галогенов
- •1.6 Применение галогенов
- •1.7 Положение в периодической таблице и общая характеристика р-элементов VIII группы
- •Лекция № 21
- •1. Определение комплексных соединений
- •1) Диссоциация сульфатов калия и алюминия
- •2) Дисоциация двойной соли – алюмокалиевых квасцов
- •3)Диссоциация комплексного соединения
- •2. Состав комплексных соединений
- •1) Комплексный ион – [Fe(сn)6]-3,
- •Примеры состава комплексных соединений
- •3. Номенклатура комплексных соединений
- •[Pt(nh3)4Cl2]Cl2 –хлорид дихлоротетраамминплатины (IV)
- •4. Диссоциация комплексных соединений
- •5. Реакции с участием комплексных соединений
- •5.1. Образование комплексных соединений
- •5.2. Преход от одного комплексного соединения к другому
- •5.3 Разрушение комплексного соединения
- •Лекция № 22
- •Введение
- •1.1. Физические свойства
- •1.2. Химические свойства
- •Вопрос № 3 Составьте уравнения реакций, протекающих при осуществлении следующих превращений Cu→Cu(no3)2→Cu(oh)2 →CuSo4.
- •Лекция № 23
- •Лекция № 24
- •2.1 Элементы триады железа
- •2.2 Платиновые металлы
- •Лекция 25 «органические соединения» введение
- •1) Замещения атомов водорода по связям с с–н,
- •2) Разрыва связей с–с.
- •1.2. Непредельные (ненасыщенные) углеводороды
- •Ацетилен с2н2, или сн±сн
- •3.3. Простые эфиры
- •3.4. Альдегиды и кетоны
- •3.5. Карбоновые кислоты
- •3.6. Сложные эфиры карбоновых кислот. Жиры
- •3.7. Амины
- •3.8. Аминокислоты и белки
- •Лекция № 26 «полимеры» Введение
- •3.Поликонденсеционные полимеры
- •4. Структура и состояния полимеров
- •Лекция № 27 «рабочие вещества низкотемпературной техники» Введение
- •1 Моль co2 – 6·1023 молекул co2 – 44г – 22,4л(н.У.).
- •1.Хладагентынеорганического происхождения
- •1.1. Номенклатура неорганических хладагентов
- •1.2. Физические и химические свойства неорганических хладагентов
- •2. Хладагенты органического происхождения (углеводороды)
- •2.1. Строение и номенклатура
- •2.2. Физические и химические свойства
- •3. Хладагенты органического происхождения (галогенпроизводные)
- •3.2.Цепные реакции(пределы взрываемости, разрушение озонового слоя)
2 Различные случаи гидролиза
Для описания гидролиза будем применять сокращенную фирму записи, включающую диссоциацию соли и взаимодействие с водой только тех ионов, которые приводят к гидролизу.
Примеры различных случаев гидролиз:
1) Гидролиз соли образованной слабым основанием и сильной кислотой
NH4CI → NH4+ + СІ-,
NH4+ + НОН ↔ NH4OH + Н+, рН< 7.
Гидролиз протекает по катиону, реакция среды кислая.
2) Гидролиз соли образованной сильным основанием и слабой кислотой
NaNО2 → Na+ + NO2-,
NO2- + НОН ↔ НNО2 + OН-.
Гидролиз протекает по аниону, реакция среды щелочная.
3) Гидролиз соли образованной слабым основанием и слабой кислотой
NH4NО2 → NH4+ + NO2-,
NH4+ + NO2-+НОН ↔ NH4OH + НNО2, рН< 7.
Гидролиз протекает как по катиону так и по аниону, реакция среды кислая так как, константа диссоциации слабой кислоты (Кд(НN02) = 6,2 10-4) больше константы диссоциации слабого основания( Кд(NH4OH) =1,8·10-5) .
Гидролиз большинства солей протекает незначительно, так как образующиеся в результате гидролиза слабые кислоты и основания обычно являются гораздо более сильными электролитами, чем вода. В большей степени гидролизуются соли образованные слабой кислотой и слабым основанием, а в случае солей содержащих многозарядные катионы и анионы может происходить полное разложение соли. Образуются в ходе гидролиза газообразные или малорастворимые соединения приводят к усилению гидролиза.
4) Гидролиз солей, образованных многозарядными катионами и анионами
Гидролиз солей, образованных многозарядными катионами и анионами, протекает ступенчато, при этом в качестве промежуточных продуктов гидролиза образуются основные соли, если гиролиз идёт по катиону, или кислые соли, если гидролиз идёт по аниону.
Na3PО4 → 3Na+ + PО4-3,
PО4-3 + НОН ↔ HPО4-2 + OH-, I-ступень,
HPО42- + НОН ↔ H2PО4- + OH-, II-ступень,
H2PО4- + НОН ↔ H3PО4+ OH-, III-ступень.
В большинстве случаев наиболее сильно процесс гидролиза протекает по первой ступени, поэтому в практических расчетах вторую и последующие ступени гидролиза обычно не учитывают.
5) Совместный гидролиз двух солей, образованных слабой кислотой и слабым основанием
При смешивании водных растворов двух солей, одна из которых образована катионом слабого основания, а другая - анионом слабой кислоты, происходит взаимное усиление гидролиза этих солей. Если кислота и основание, образующие эти соли, не только слабые электролиты, но и малорастворимые или разлагающиеся с образованием летучих продуктов, то гидролиз часто протекает необратимо. При этом образуются конечные продукты гидролиза - слабое основание и слабая кислота.
Совместный гидролиз хлорида алюминия и сульфида натрия
2 АlСІ3 + 3 Na2S + 6 НОН ↔ 2 А1(ОН)3 + 3 H2S + 6 NaCl,
2 Al3+ + 3 S2- + 6 НОН ↔ 2 А1(ОН)3 + 3 H2S.
В данном случае гидролиз протекает до образования конечных продуктов.
3 Гидролиз кислых солей
В случае гидролиза кислых солей параллельно с процессом гидролиза идет процесс диссоциации кислых ионов, содержащихся в кислотном остатке аниона кислоты. Реакция среды определяется тем, какой процесс преобладает. Эго можно выяснить, сравнив константы гидролиза и диссоциации анионов кислой соли.
Пример гидролиза дигидроортофосфата натрия
1) Гидролиз
Na H2PО4 → Na+ + H2PО4-,
H2PО4- + НОН ↔ H3PО4+ OH- Кг = 1,4·10-12.
2)Диссоциация кислого иона
H2PО4- ↔ HPО42- + Н+ Кд2= 6,2·10-8.
Реакция среды в данном случае будет кислая, так как Кг меньше Кд2(Н3РО4), т.е. процесс диссоциации преобладает над процессом гидролиза.
4 Константа гидролиза
Гидролиз солей в большинстве случаев протекает обратимо. Поэтому для процесса гидролиза, как и любого равновесного процесса, можно записать выражение константы равновесия (Кр).
Пример гидролиза ацетата натрия –
СН3СОО- + Н+ОН- ↔ СН3СООН + ОН-.
Кр
=
![]()
 .
.
В полученном выражении концентрацию воды можно перенесли влево, так как в разбавленных водных растворах её исходная и равновесная концентрации практически совпадают. И после умножения числителя и знаменателя отношения на концентрацию ионов водорода, получим в числителе ионное произведение воды, а в знаменателе константу диссоциации уксусной кислоты.
Кг![]()
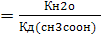 .
.
Поставив в приведенное выражение значение ионного произведения воды 10-14 и константу диссоциации для уксусной кислоты ~10-5 получаем Кг~10-9, т.е. гидролиз протекает незначительно. При переходе к общему выражению
Кг
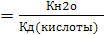
видно, что чем слабее кислота, образующаяся в ходе гидролиза, тем в большей степени протекает гидролиз.
Если соль гидролизуется по катиону, то в общем виде константа гидролиза будет иметь вид
Кг
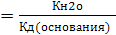 .
.
Из приведенного выражения следует, что чем слабее основание, образующаяся в ходе гидролиза, тем в большей степени протекает гидролиз.
В случае соли гидролизующейся как по катиону так и по аниону выражение константа гидролиза имеет вид
Кг
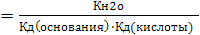 .
.
Так как в знаменатель входит произведение Кд слабых кислот и основания, гидролиз данных солей протекает в большей степени.
