- •Раздел I
- •Теоретические аспекты электрохимических процессов
- •Раздел II
- •2.1. Стандартные электродные потенциалы.
- •2.2. Вычисление электродных потенциалов металлических электродов.
- •2.3. Электроды и электродные процессы в гальваническом элементе.
- •2.4. Электродвижущая сила гальванического элемента.
- •2.5. Электрохимическая коррозия металлов.
- •Раздел III
- •Примеры решения задач к разделу III.
- •Библиографический список
2.1. Стандартные электродные потенциалы.
Задание: С какими солями в водных растворах реагирует указанный металл?
|
Металл |
Соли |
||||
a |
Цинк |
MnSO4 |
AlCl3 |
Pb(NO3)2 |
Hg(NO3)2 |
NaCl |
b |
Никель |
CuSO4 |
AgNO3 |
Al(NO3)3 |
MnCl2 |
KNO3 |
c |
Магний |
Hg(NO3)2 |
NaCl |
ZnSO4 |
Ca(NO3)2 |
Na3PO4 |
d |
Железо |
ZnCl2 |
CuSO4 |
AgNO3 |
CaCl2 |
MnSO4 |
e |
Олово |
KNO3 |
MgCl2 |
Cu(NO3)2 |
AgNO3 |
NiSO4 |
f |
Алюминий |
MgSO4 |
NaCl |
CuSO4 |
PbSO4 |
FeCl3 |
g |
Свинец |
AgNO3 |
Al2(SO4)3 |
MnCl2 |
MgCl2 |
K2SO4 |
h |
Медь |
MnSO4 |
Pb(CH3COO)2 |
AgNO3 |
AlCl3 |
CaSO4 |
i |
Ртуть |
CaCl2 |
ZnSO4 |
Mg(NO3)2 |
CuSO4 |
MnSO4 |
j |
Марганец |
ZnSO4 |
Ca(NO3)2 |
KNO3 |
Hg(NO3)2 |
AgNO3 |
k |
Олово |
ZnCl2 |
NiSO4 |
Cu(NO3)2 |
LiCl |
Al2(SO4)3 |
l |
Серебро |
K3PO4 |
Hg(NO3)2 |
Ba(NO3)2 |
CuSO4 |
FeSO4 |
m |
Железо |
KCNS |
SnCl2 |
Pb(NO3)2 |
CrCl3 |
MgSO4 |
n |
Никель |
AgNO3 |
Al(NO3)3 |
KCl |
ZnSO4 |
CaCl2 |
o |
Цинк |
BaCl2 |
Bi(NO3)3 |
CdSO4 |
K2SO4 |
MnCl2 |
Для решения задачи воспользуйтесь значениями стандартных электродных потенциалов (СЭП). Каждый из металлов способен окисляться катионами всех других металлов, для которых величина СЭП (φ0)выше.
Непременным условием протекания реакции
является соотношение: φокислителя
> φвосстановителя. Так,
например, металл Zn является
восстановителем катионов Fe2+,
Ni2+, Cu2+
и др., для которых
![]()
Zn + FeSO4 = ZnSO4 +Fe
Zn – 2e = Zn2+ - окисление
Fe2+ + 2e = Fe - восстановление
2.2. Вычисление электродных потенциалов металлических электродов.
Задание: Вычислить электродный потенциал металлического электрода при заданной активной концентрации (активности) катионов металла.
|
Металл |
Активность ионов металла, моль/л |
a |
Железо |
0,001 |
b |
Марганец |
0,001 |
c |
Цинк |
0,01 |
d |
Никель |
0,0001 |
e |
Хром |
0,001 |
f |
Медь |
0,001 |
g |
Серебро |
0,1 |
h |
Свинец |
0,01 |
i |
Олово |
0,0001 |
j |
Цинк |
0,0001 |
k |
Железо |
0,001 |
l |
Цинк |
0,01 |
m |
Хром |
0,001 |
n |
Олово |
0,01 |
o |
Медь |
0,001 |
Электродный потенциал окислительно-восстановительной системы рассчитывается по уравнению Нернста.
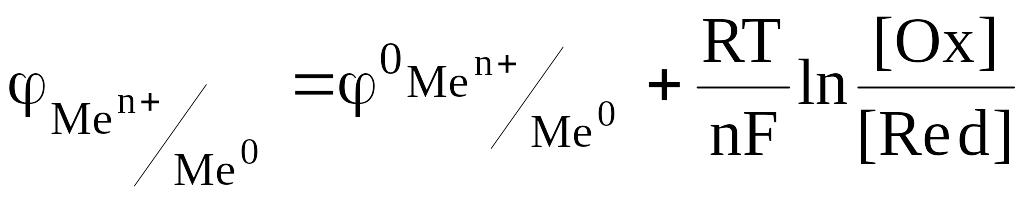
где
![]() стандартный электродный потенциал
металла, В; n – заряд иона металла; [Ox]
и [Red] – концентрация окисленной и
восстановленной формы ионов металла в
растворе его соли, моль/л; R- универсальная
газовая постоянная, R=8,31 Дж/моль.К;
Т - температура, Т=298 К; F-
постоянная Фарадея, F=96500 Кл/моль.
стандартный электродный потенциал
металла, В; n – заряд иона металла; [Ox]
и [Red] – концентрация окисленной и
восстановленной формы ионов металла в
растворе его соли, моль/л; R- универсальная
газовая постоянная, R=8,31 Дж/моль.К;
Т - температура, Т=298 К; F-
постоянная Фарадея, F=96500 Кл/моль.
Для металлических электродов при стандартных условиях (Р=101,3 кПа, Т=298 К) уравнение принимает вид: