- •Ключевые вопросы.
- •Раздел 2 Структурно – логические схемы.
- •1Есть вещества (гелий, неон и др) –молекулы которых состоят из одного атома.
- •1. Масса веществ вступивших в реакцию равна массе веществ, образовавшихся в ее результате.
- •Раздел 3. Обучающие тесты.
- •1.Введение.Вещество.
- •2.Чистые(индивидуальные) вещества и смеси. Разделение смесей.
- •3.Физические и химические явления. Определение предмета химии.
- •4.Химические элементы. Атомы. Периодическая система химических элементов
- •5.Молекулярный и немолекулярный состав веществ. Молекулы. Химические формулы. Закон постоянства состава.
- •6.Классификация веществ. Простые и сложные вещества. Аллотропия.
- •7.Относительная атомная и молекулярная масса. Качественный и количественный состав вещества.
- •8.Закон сохранения массы веществ. Уравнения химических реакций. Типы химических реакций.
- •Раздел 4. Творческие задания. Задачи.
- •Раздел 5. Ответы.
- •1.Введение.Вещество.
- •2.Чистые(индивидуальные) вещества и смеси. Разделение смесей.
- •3.Физические и химические явления. Определение предмета химии.
- •4.Химические элементы. Атомы. Периодическая система химических элементов
- •5. Молекулы. Химические формулы. Закон постоянства состава.
- •6.Классификация веществ. Простые и сложные вещества. Аллотропия.
- •7.Относительная атомная и молекулярная масса. Качественный и количественный состав вещества.
- •8.Закон сохранения массы веществ. Уравнения химических реакций. Типы химических реакций.
- •5.2. Ответы к творческим заданиям и задачам (раздел 4).
- •Лист самоконтроля.
- •5.1. Обучающие тесты (раздел 3).
- •1.Введение. Вещество.
- •2.Чистые (индивидуальные) вещества и смеси. Разделение смесей.
- •3.Физические и химические явления. Определение предмета химии.
- •4.Химические элементы. Атомы. Периодическая система химических элементов
- •5. Молекулы. Химические формулы. Закон постоянства состава.
- •6.Классификация веществ. Простые и сложные вещества. Аллотропия.
- •7.Относительная атомная и молекулярная масса. Качественный и количественный состав вещества.
- •8.Закон сохранения массы веществ .Уравнения химических реакций. Типы химических реакций.
- •5.2. Ответы к творческим заданиям и задача. (раздел 4).
1Есть вещества (гелий, неон и др) –молекулы которых состоят из одного атома.

Часто говорят и пишут:
«Все вещества состоят из молекул, а молекулы – из атомов».
(атомно-молекулярное учение)
Это утверждение условно и ограниченно. В ходе изучения химии эти представления будут развиваться и уточняться
5.3. Химические формулы. Закон постоянства состава вещества.
** |
Молекулярные |
Немолекулярные |
||
1 |
Молекула |
2 |
3
4 |
Атом-ионы |
Химическая формула вещества |
Молекулярная |
Наименьший повторяющийся фрагмент – структурная единица (формульная единица) |
||
Пример записи |
H2O |
C |
NaCl |
Cu |
Вещество |
Вода |
Алмаз |
Поваренная соль |
Медь |
Химическая формула – условная запись состава вещества |
||||
|
||||
Упрощенно для школьного курса
химии считаем, что все вещества имеют
постоянный состав. Это
допущение позволяет рассматривать
закономерности и т.п. практически без
искажения.
*Вещества немолекулярного
строения могут иметь
постоянный,
близкий к постоянному, непостоянный
состав.
Постоянный состав имеют
вещества молекулярного строения.




|
6.1. Классификация веществ по составу.
Вещества |
Простые |
Состоят из атомов одного химического элемента |
Водород: Н2 Медь: Cu Алмаз: С |
Сложные |
Состоят из атомов разных химических элементов (химические соединения)
|
Вода: Н2О Сахар: С12Н22О14 Поваренная соль: NaCl Кварц: SiO2 |
Различайте:
«смесь веществ» и «сложное вещество»
6.2. Аллотропия.
|
Многие химические элементы способны образовывать разные простые вещества – аллотропные видоизменения. Аллотропы имеют разное строение, но состоят из атомов одного химического элемента. Явление называют аллотропией. |
|||
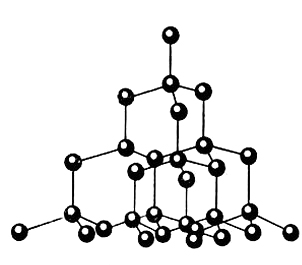
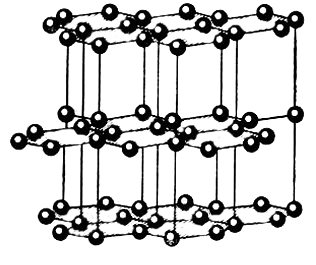
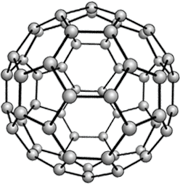
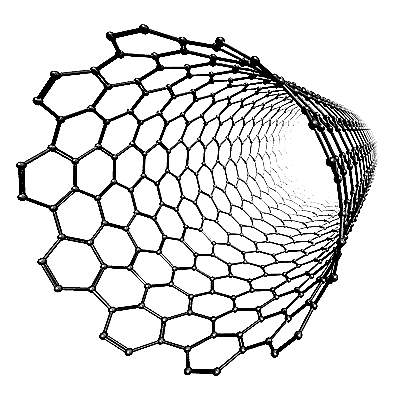
Химический элемент углерод |
Алмаз фрагмент |
Графит фрагмент |
Фуллерен Молекула Одна из видов |
Нанотрубка фрагмент Один из видов |
Модели аллотропных модификаций углерода. |
|
|
|
|
Химическая формула |
С |
С |
С60 |
С |
Существуют и другие простые вещества из атомов углерода. |
||||
6.3. Формы существования химического элемента
Формы существования химического элемента |
||
Отдельные атомы |
Простые вещества |
Сложные вещества |
Атомы водорода в момент образования существуют доли секунды |
Водород – Н2 – легкий газ |
Вода – Н2О – в составе молекул содержит атомы водорода |

7.1. Понятия «относительный» и «относительная масса».
Действия |
Объекты |
||
1 |
2 |
3 |
|
Берем за единицу измерения как эталон (или относительно чего измеряем): **Условия измерения: на планете Земля, не более 100м от ее поверхности. |
Цилиндр из сплава платины (90%) и иридия (10%) (макрообъект1). |
Моего кота (макрообъект). |
1. Атом углерода (микрообъект2). 2. Разделим его на 12 частей. 3. «вынем» эту 1\12 часть и примем за единицу измерения |
Называем: |
Один килограмм (1кг). Весь мир сделал по эталону такие «гирьки» и говорит на одном языке о массе. |
Один кот (1кот). На домашних весах равно 4,00 кг. |
Одна атомная единица массы (1 а.е.м.). Упростим для этой таблицы – «1 аем» |
Чем гарантируется точность измерений |
Масса эталона свято соблюдается и проверяется. Для этого есть службы в каждом городе. |
Масса эталона меняется в течение дня, тем более по месяцам и годам. |
Атом углерода не меняется по массе. |
Точность измерений |
Высокая |
Низкая |
Высокая |
Эксперимент №1: Измерение массы моей собаки (макрообъект). |
20 кг.
|
5 котов (после несложных расчетов в уме)
|
Не можем без логических размышлений и математических расчетов на бумаге.
|
Удобство измерений |
Удобно. |
Удобно. |
Неудобно. |
Эксперимент №2: Измерение массы атома углерода (микрообъект). |
Не можем без логических размышлений и математических расчетов. |
Не можем без логических размышлений и математических расчетов. |
Несложные расчеты в уме: Масса атома углерода =12 аемов. |
Удобство измерений |
Неудобно |
Неудобно |
Удобно |
Масса измерялась: |
Относительно массы этого куска металлического сплава |
Относительно массы моего кота |
Относительно массы 1\12 части атома углерода |
Величина удобных измерений показала: |
Во сколько раз масса собаки больше массы этого куска металлического сплава. |
Во сколько раз масса моей собаки больше массы моего кота |
Во сколько раз масса атома углерода больше 1\12 массы атома углерода. |
Выводы с учетом точности измерений |
Удобно с высокой точностью измерять массы объектов макромира |
Удобно с низкой точностью измерять массы объектов макромира |
Удобно с высокой точностью измерять массы объектов микромира |
1Макрообъект – можем взять руками, либо пинцетом , либо другим возможным прибором и взвесить на бытовых, промышленных или лабораторных весах.
2Микрообъект – настолько мал, что не можем взять в руки и взвесить ни на бытовых, промышленных и лабораторных весах. Ученые нашли возможности для сравнений масс, и результаты представили нам в удобном виде.
Придумайте свои эталоны массы, назовите их и измерьте массу окружающих предметов в этих единицах.
*Придумайте свои эталоны объема, длины, **плотности и измерьте в этих единицах объекты макромира.
7.2. Относительная атомная и относительная молекулярная массы.

7.3. Качественный и количественный состав веществ.
|
Качественный состав |
Количественный состав |
Что показывает |
виды атомов химических элементов в составе вещества |
количество атомов каждого химического элемента в составе вещества
|
Пример описания для воды |
Молекулы воды состоят из атомов двух химических элементов – водорода и кислорода |
Молекула воды состоит из двух атомов водорода и одного атома кислорода (итого три атома в составе) |
7.4.Определение массовой доли химического элемента в веществе.
Определение количественного состава вещества по массовой доле.
Массовая доля химического элемента в веществе |
|
обозначение |
ω(символ химического элемента) |
Пример: массовая доля водорода в воде |
ω(Н) |
Что показывает |
Долю массы всех атомов водорода в массе молекулы воды
|
Как рассчитывается |
ω(Н) = Аr(H)•n/ Mr(H2O) = 1*2/1*2+16= 0,11 или 11% отношение масс всех атомов водорода к массе молекулы (в атомных единицах массы) |
Единицы измерения |
Величина безразмерная. Если умножить на 100%, то измеряется в % |
**Как определить состав молекулы по массовым долям элементов?
Пример задачи. |
|
Известно, что вещество состоит из атомов углерода и водорода, массовая доля углерода 75%. Относительная молекулярная масса вещества равна 16. |
|
Вещество состоит из атомов двух элементов. Пусть число атомов углерода x, число атомов водорода y. Состав вещества можно записать так: |
СхНу |
Сумма массовых долей этих элементов составляет 100%.
|
Если ω(С) 75% (или 0,75), то ω(Н) = 100 – 75 = 25% (или 0,25)
|
Формула для расчета массовой доли углерода |
ω(С) = Аr(С)•х/ Mr(СхНу) |
Преобразуем формулу для расчета х – числа атомов углерода: |
х = ω(С) • Mr(СхНу)/ Аr(С) = 0,75•16/12 = 1 в составе молекулы 1 атом углерода |
Рассчитаем число атомов водорода, также преобразовав формулу: |
Т.к. ω(Н) = Аr(Н)•у/ Mr(СхНу), то у = ω(Н) • Mr(СхНу)/ Аr(Н) = 0,25•16/1=4 в составе молекулы 4 атома водорода |
Запишем формулу вещества |
СН4 |
Можно проверить правильность расчетов, рассчитав относительную молекулярную массу вещества: |
Mr(СН4)= 1• Аr(С) + 4• Аr(Н) = 12+4=16 |









 Например:
Например: