
- •Методичні вказівки
- •«Газопостачання»
- •Властивості і склад газоподібного палива
- •Практичне заняття № 1
- •1. Основні закони газового стану
- •1. 1. Закон Бойля - Маріотта
- •1. 2. Закон Гей-Люссака
- •1. 3. Закон Авогадро
- •1. 4. Рівняння Клапейрона
- •5. Закон Дальтона
- •1. 6. Закон Гейама (Гремма)
- •1. 7. Закон Рауля
- •1. 8. Середній моль - вага суміші
- •Практичне заняття № 2 Особливості використання зрідженого газу
- •Практичне заняття № 3 Установки зрідженого газу
- •Практичне заняття № 4
- •4.1. Точка роси
- •4.2. Діаграма стану
- •Практичне заняття № 5 Методи наповнення сховищ
- •Практичне заняття № 6 Реакції горіння газів
- •Практичне заняття № 7 Температури горіння газів
- •7.2. Концентраційні межі вибуховості газоповітряних сумішей
- •Практичне заняття № 8
- •8.1. Швидкість поширення полум'я
- •8.2. Відрив полум'я
- •Список літератури
5. Закон Дальтона
Суміш газів підкоряється закону Дальтона, згідно з яким загальний тиск суміші дорівнює сумі тисків окремих компонентів, що утворюють суміш, тобто сумі парціальних тисків :
P=P1+P2+..+Pn. (1.17)
Парціальним тиском називається тиск, який має кожен газ в об'ємі суміші при температурі суміші. При цьому парціальний тиск кожного компонента дорівнює загальному тиску, помноженому на величину об'ємного (молярного) вмісту цього компонента в суміші.
Pi=riP. (1.18)
Аналогічно закону Дальтона, Амага запропонував закон адитивності парціальних об'ємів, згідно з яким загальний об'єм газової суміші дорівнює сумі парціальних об'ємів компонентів суміші:
V=V1+V2+...+Vn (1.19)
Під парціальним об'ємом компонентів ідеальної газової суміші розуміється об'єм, який займав би цей компонент за відсутності інших, знаходячись в такій же кількості, під тим же тиском і при тій же температурі, що і в суміші.
Парціальний об'єм кожного компонента газової суміші дорівнює загальному об'єму, помноженому на об'ємну (молярну) концентрацію його в суміші:
Vi=riV. (1.20)
Співвідношення між
кількістю окремих газів, що входять в
суміш, можуть задаватися об'ємним або
ваговим складами. Об'ємний склад газових
сумішей являється одночасно і молярним
складом, оскільки об'єм 1 кмоля
вуглеводневого газу є величина постійна,
рівна
![]() 22,4
нм3.
22,4
нм3.
1. 6. Закон Гейама (Гремма)
Швидкість дифузії газу назад пропорційна корню квадратному з його щільності.
Поширюючи цей закон на витікання газу з малих отворів, закон Гейама свідчить, що при однакових тисках і температурах швидкості витікання різних газів з малих отворів назад пропорційні корінню квадратному з їх щільності , тобто
![]() . (1.21)
. (1.21)
Час витікання газів через отвори обернено пропорційно до швидкостей витікання цих газів w :
![]() . (1.22)
. (1.22)
Швидкість витікання визначається по формулі:
W=![]() , (1.23)
, (1.23)
де Р1 і Р2 - початковий і кінцевий тиск; - щільність газу.
(1.22)
1. 7. Закон Рауля
Всі зріджені вуглеводневі гази взаємно розчинні один в одному, тому до них при невисоких тисках з достатньою для практики точністю застосуємо закон Рауля.
Парціальний тиск
Рi
будь-якого компонента в рідкій суміші
дорівнює
молекулярній концентрації його в рідкій
фазі Хi
помноженій на пружність його пари
![]() в чистому вигляді при цій температурі,
тобто
в чистому вигляді при цій температурі,
тобто
Рi =Xi (1.24)
Загальний тиск або пружність пари рідини Р, що складається з декількох компонентів, дорівнює сумі парціальних тисків цих компонентів :
Р=Р1+Р2+...+Рn=![]() i
(1.25)
i
(1.25)
1. 8. Середній моль - вага суміші
Mсум=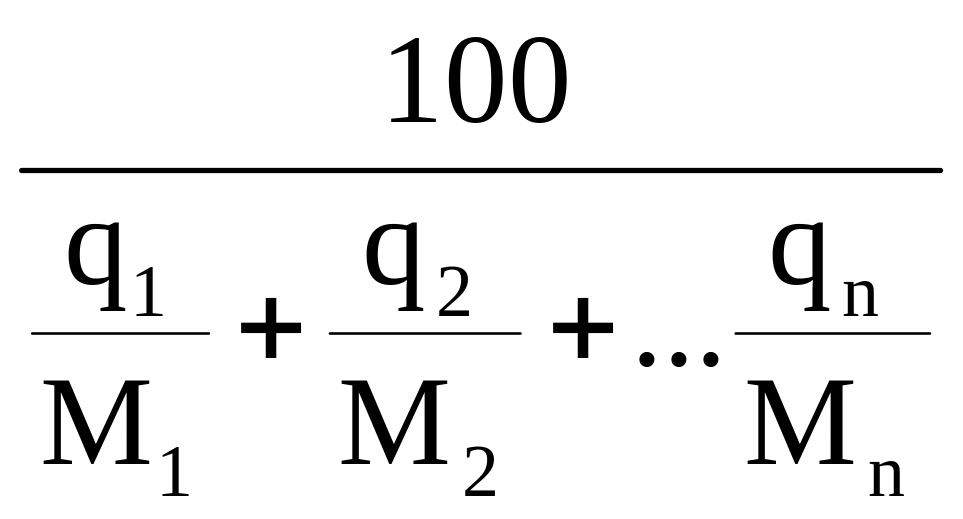 (1.26)
(1.26)
де q1, q2 -вміст компонентів в суміші.
1. 9. Об'єм пари при випаровуванні рідини
V=![]()
22,4
(1.27)
22,4
(1.27)
де G - вага суміші (дорівнює числу моль), кг; М - моль, вага, кг/моль; 22,4 м3 - об'єм 1г - моль.
Vсм=(![]() )22,4
(1.28)
)22,4
(1.28)
Практичне заняття № 2 Особливості використання зрідженого газу
При проектуванні установок зрідженого газу можливість застосування того або іншого газу визначається тиском газу в місткостях, робочою температурою зовнішнього повітря і складом газу.
Тиск газу в ємності із зрідженим газом має бути таким, щоб не відбувалося скіпання рідини. Від величини тиску залежить вага місткостей, а отже і економічність використання газу. Відповідно до цього, пружність насичених газів в місткості має бути не вище 1,6 МПа.
Для здійснення регазификации (випаровування) зрідженого газу в місткостях, щоб отримати тиск, необхідний для роботи установки, бажано використовувати тепло навколишнього повітря, оскільки інакше виникає необхідність штучного підігрівання рідини для його випаровування. Температуру в місткості можна приймати на 5 - 60С нижче за температуру зовнішнього середовища. Мінімальний необхідний тиск в місткості для роботи установки з урахуванням втрат тиску в пальнику і регулювальнику тиску можна приймати 0,1 МПа.
Для отримання необхідного тиску газу визначають також склад зрідженого газу при цій температурі зовнішнього повітря. Для суміші пропана з бутаном користуються графіком, для суміші інших газів і для суміші 3-х і більше газів - законом Дальтона.
Приклади
1. Визначити парціальні тиски компонентів, що входять до складу повітря, що знаходиться при нормальному тиску.
Рішення.
Об'ємний склад повітря: О2 - 21%, N2 - 79%, оскільки парціальні тиски компонентів пропорційні їх об'ємним (молярним) концентраціям за законом Дальтона:
Рi=riP , то РО2=7600,21=160 мм. рт. ст.
РN2=7600,79=600 мм. рт. ст.
2. Визначити парціальні тиски компонентів, що входять в газову суміш наступного об'ємного складу, - СН4 - 90%, С2Н6 - 5%, С3Н8 - 5%. Суміш знаходиться під тиском 10 атм.=1 МПа
Рішення.
РСН4=0,910=0,9 МПа
РС2Н6=0,0510=0,05 МПа
РС3Н8=0,0510=0,05 МПа.
3.Визначити теплоту згорання газоподібного палива, що має наступний склад (у відсотках за об'ємом), :
СН4 - 96% ,С2Н6 – 0,8% ,С3Н8 – 0,3% ,С4Н10 – 0,8% ,СО2 – 0,5%, N2 - 1%.
Рішення.
=0,01(96,635840+0,863730+0,393370+0,8123770) = 363990 (кДж/м3).
4. Балон із зрідженим газом, Р=0,1МПа і t=200С, нагрівали до t=500С. Визначити тиск в балоні після нагрівання.
Рішення.
Застосуємо закон Шарля :
Р2=Р1![]() ; Р2=0,1
; Р2=0,1![]() =0,11
Мпа
=0,11
Мпа
5. Продукти згорання газу охолоджуються від 926 0С до 327 0С. Визначити в скільки разів зменшиться їх об'єм.
Рішення.
Згідно із законом Гей-Люссака :
![]()
![]() =2.
=2.
6. По газопроводу протягом години подається 1000 м3 природного газу при абсолютному тиску 0,2МПа і t=200С. Виразити цей об'єм газу при н.у.
Рішення.
Використовуємо об'єднаний закон Бойля - Маріотта.
V2=1000![]() =1920
м3.
=1920
м3.
7. Визначити щільність газу робочого складу прикладу 1.4.3.
Рішення.
Щільність газу визначається як сума творів значень щільності компонентів на їх об'ємні долі
Рc=0,01(96,60,717+0,81,357+0,32,019+0,82,703+0,51,977+11,251)=0,156 кг/м3.
Відносна щільність газу (по повітрю) :
Sc=![]() =0,585.
=0,585.
Основною характеристикою газу є сухий склад, але оскільки використовуваний газ буває вологим, може виникнути необхідність перерахунку , с, Sc на робочий склад (з урахуванням вологості газу) :
р=(с+d)К
кг/м3;
=![]() К,
К,
де
К=![]() ;
d
- вологовміст
газу (кг/м сухого газу при н.у.).
;
d
- вологовміст
газу (кг/м сухого газу при н.у.).
8. Визначити робочий склад газу и р вважаючи, що d=0,005кг/м3
Рішення.
К=![]() =0,994.
=0,994.
Робочий склад газу буде наступний: CН4=95,993; С2Н6=0,795; С3Н8=0,298; С4Н10=0,795; СО2=0,497; N2=0,994; Н2О=0,628..
Щільність вологого газу =(0,756+0,005)0,994=0,757 кг/м3.
Теплота згорання робочого складу =363900,994=36170кг/м3
9. Визначити щільність СН4 при t=200С і Р=760 мм. рт. ст.(при t=200 і Р=1МПа), якщо Р н.у.=0,7168 кг/нм3.
Рішення.
20,760=0,7168![]() =0,67
кг/м3 (стандартні
умови);
=0,67
кг/м3 (стандартні
умови);
20,1=0,7168![]() =6,67
кг/м3.
=6,67
кг/м3.
10. Визначити загальний тиск суміші зріджених газів при t=+200C
якщо міль - склад рідини наступний: С3Н8 - 80%, С4Н10 - 20%.
Рішення.
Р=0,8(0,85+0,2(0,205=0,72 МПа.
11. Визначити об'єм пари при н.у., що виходять при випаровуванні 1000 кг суміші наступного вагового складу, :
C4Y10 - 50%; M=58,12; C3H8 - 50%; М=44,09.
Рішення.
Середня молекулярна вага суміші для складу газу, вираженого у вагових відсотках, розраховується так:
Mcум=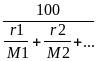 ,
,
де q1, q2, qn - ваговий, процентний або пайовий вміст компонентів
Мсум=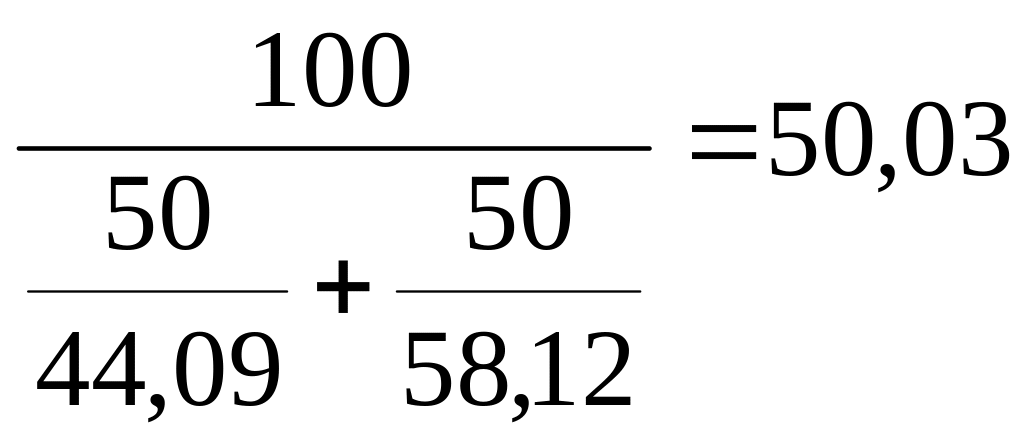 ; V=
; V=![]() нм3.
нм3.
12. 100м3 - СН4, що знаходиться при тиску 10 ата, змішані з 40 м3 - С3Н8, що знаходиться при тиску 5 ата, і поміщені в газгольдер місткістю 200м3. Визначити парціальні тиски компонентів в газгольдері, загальний тиск газу в газгольдері і об'ємний склад суміші.
Рішення.
Визначення парціальних тисків компонентів зводиться до приведення кожного газу до нового загального об'єму суміші після пререміщення її в газгольдер:
РСН4=![]() ата; РС3Н8=
ата; РС3Н8=![]() ата
ата
Загальний тиск суміші в газгольдері:
Р=1+5=6 ата.
Об'ємний склад суміші :
СН4 -5:6=0,835=83,5%;
С3Н8 -1:6=0,165=16,5%.
13. Вичислити питому вагу змішаного газу, що складається з 50% С3Н8 і 50% Н-Бутану за об'ємом при Р=760 мм. рт. ст. і t=00С (при завданні об'ємного складу в долях одиниці [7, стор. 34, таблиця.1.8].
=0,5С3Н8+0,5С4Н10=2,35 кг/нм3.
