Пептиди
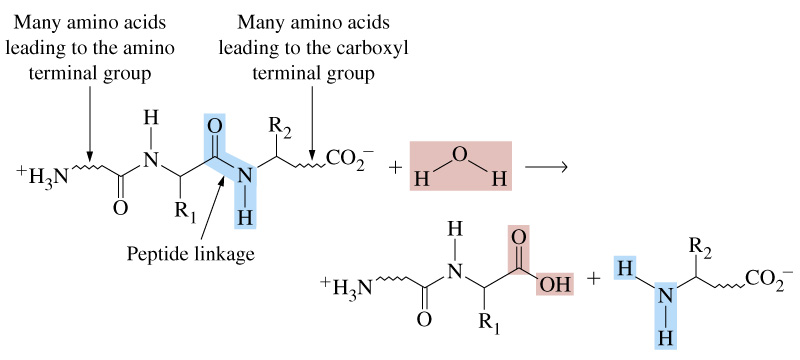
Пептиди (від грецького – зварений, переварений) – органічні сполуки, які складаються із залишків однакових або різних амінокислот, що сполучені пептидними зв’язками ( ‑ CO – NH ‑ ).
-
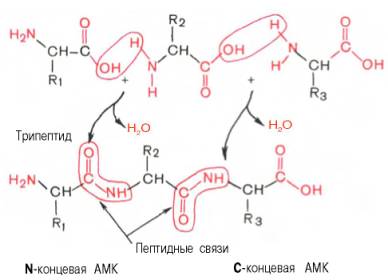
Схема утворення трипептиду.
Хімічний синтез поліпептидів і сучасні фізико-хімічні методи дослідження білків повністю підтвердили наявність пептидних зв’язків в структурі білка.
Назва пептиду складається: назва першої N-кінцевої амінокислоти з вільною NH2-групою (закінчення -ил, -іл типове для ацилів) + назва наступних амінокислот (також із закінченнями –ил, -іл) + повна назва С-кінцевої амінокислоти з вільною СООН-групою. Наприклад, пентапептид з 5 амінокислот може названий: гліцил-аланіл-серил-цистеінил-аланін, або скорочено Гли–Ала–Сер–Цис–Ала.
Способи одержання:
З природних джерел: неповним гідролізом білків одержують з тканин тварин карнозин, глутатіон, ансерин. Потім їх видаляють та ідентифікують звичайними методами якісного і кількісного аналізу органічних речовин. Окремі пептиди з таких тканин одержують методом екстракції.
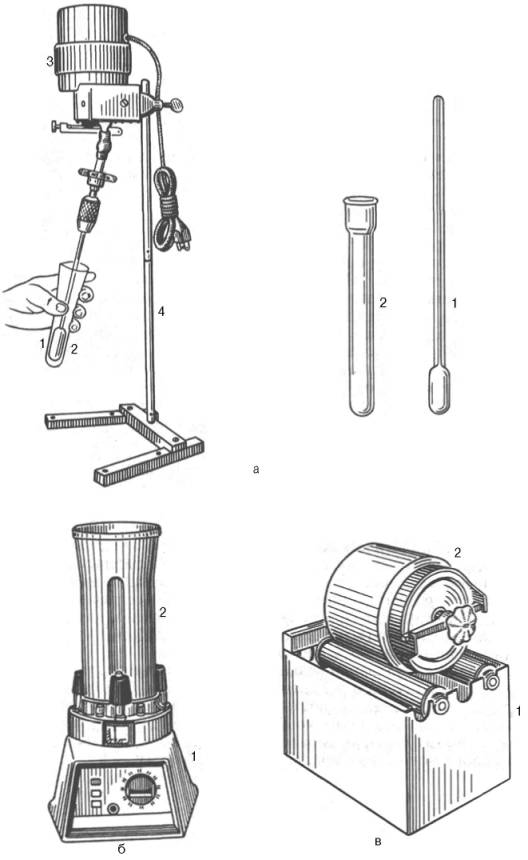
а ‑ ручной гомогенізатор;
б – механічний гомогенізатор;
в – шаровий млин.
Методами органічного синтезу (реакції синтезу пептидів і захисту під час синтезу їх аміногруп і карбоксильних груп від вступу в реакції з іншими реагентами. Синтез можна продовжити повторенням попередніх стадій). Так було синтезовано інсулін, багато пептидів, їх видаляють із сумішей звичайними методами виділення та ідентифікації органічних речовин, нерідко використовуючи хроматографію, електрофорез.
-

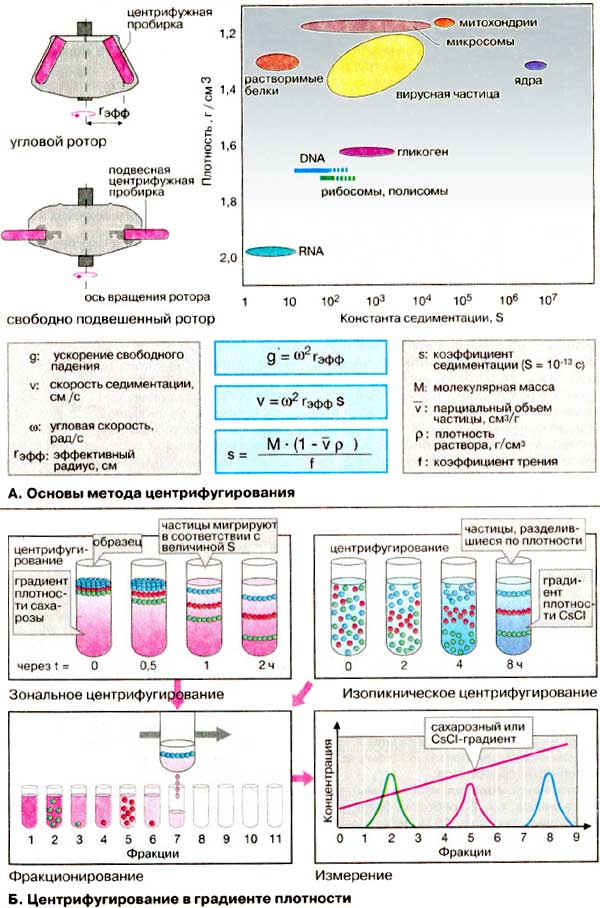
Схема електрофорезу
Центрифугування
Фізичні властивості:
Низькомолекулярні пептиди – кристалічні речовини, розчинні у воді і за своїми властивостями подібні до амінокислот. Не здатні денатурувати. В розчинах утворюють конформери.
Високомолекулярні пептиди (поліпептиди) – аморфні речовини, у воді утворюють колоїдні розчини. За своїми фізико-хімічними властивостями вони близькі до білків. Молекулярну масу мають нижче 6000. Не здатні денатурувати. В розчинах формується вторинна структура – α-спіраль і β-структури.
Хімічні властивості:
Молекули дипептидів ‑ біполярні іони.
Пептиди – амфотерні сполуки, вступають в реакції, що характерні для α-амінокислот.
При гідролізі розщеплюються до амінокислот:
Кислотний гідроліз (під дією 5,7Н розчину НСІ протягом 24год. при 105 С):
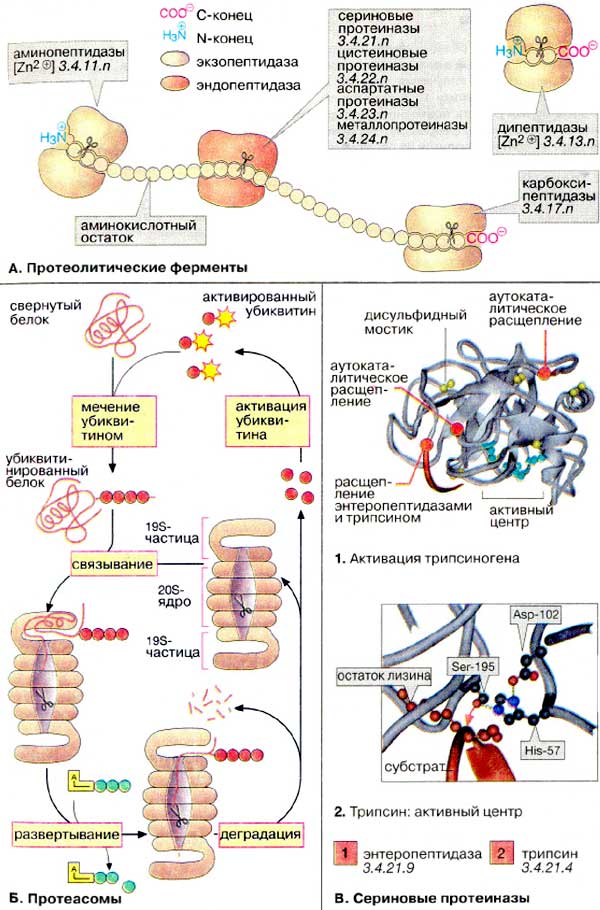
Ферментативний гідроліз (під дією ферментів тваринного і мікробного походження – пептидаз).
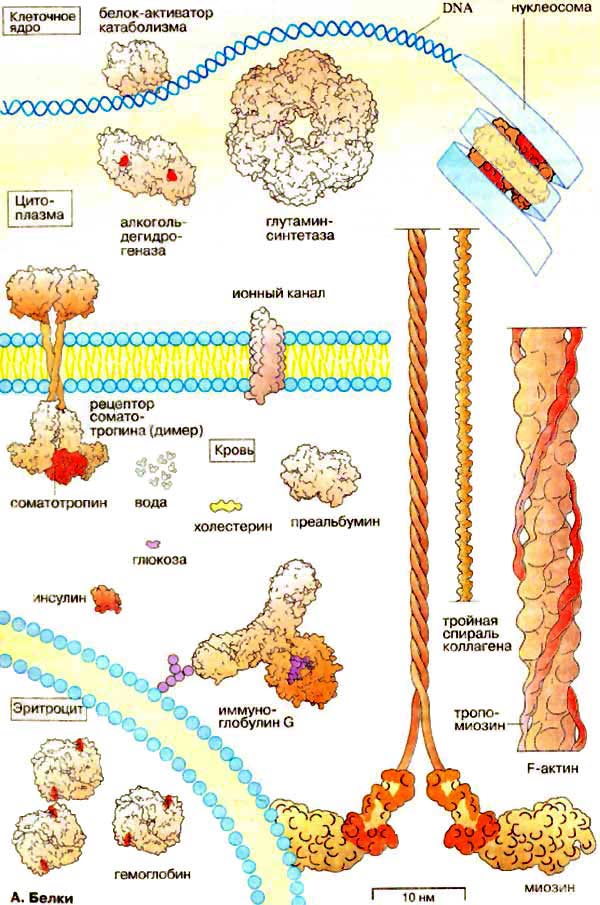
Білки
Білки – високомолекулярні органічні сполуки, що побудовані із залишків α-амінокислот, які сполучені між собою пептидними зв’язками в довгі поліпептидні ланцюги (прямі і закручені). Молекулярна маса білків коливається в діапазоні від кількох тисяч (інсулін – 5700) до сотень мільйонів (білок вірусу грипу – 322млн.).
Білки становлять структурну і функціональну основу всіх живих організмів.
Білки є основною азотистою сполукою харчових продуктів, забезпечують до 15% енергоцінності добового раціону. Добова потреба людини в білках становить 80-100г, половину з яких повинні складати тваринні білки.
Функції білків в організмі:
Структурна функція. Забезпечується структурними білками, які відповідають за підтримання форми і стабільності клітин і тканин. Приклади: колаген, гістони (організують укладання ДНК в хроматині).
Транспортна функція. Забезпечується білками: гемоглобін (переносник кисню та вуглекислого газу до тканин і легень), преальбумін (переносник гормонів щитовидної залози – тироксин і трийодтиронін), іонні канали (транспорт іонів і метаболітів через біологічні мембрани).
Захисна функція. Забезпечує білок-імуноглобулін G, який утворює на еритроцитах комплекс з мембранними гліколіпідами.
Регуляторна функція. В біохімічних сигнальних ланцюгах білки виконують функції сигнальних речовин (гормонів) і гормональних рецепторів. Наприклад, комплекс гормону росту соматотропіну з відповідним рецептором, інсулін (гормон, що регулює вуглеводний обмін).
Каталітична функція. Забезпечують ферменти.
Рухома функція. Взаємодія актину з міозином відповідає за м’язові скорочення та інші форми біологічної рухомості.
Запасні функції. Забезпечуються запасними білками, які містяться в рослинах, і є цінними харчовими речовинами. В організмах тварин м’язові білки служать резервними харчовими речовинами, які мобілізуються при потребі.
Фізико-хімічні властивості білків:
Рідкі, напіврідкі, тверді аморфні та кристалічні речовини. Деякі білки мають консистенцію в’язких рідин або драглів (альбуміни, глобуліни сироватки крові).
При високій температурі всі білки згоряють, відчувається запах паленого волосся.
Не мають температури плавлення та кипіння, так як згортаються при нагріванні.
Оптично активні речовини. Розчини природних білків обертають площину поляризації світла ліворуч так як складаються переважно з α-амінокислот.
розчинність білків ‑ різна: нерозчинні (колаген, еластин), альбуміни розчиняються у воді з утворення колоїдних розчинів, проламіни – у сумішах спиртів.
Білки утворюють колоїдні розчини, які здатні переходити в гелі (драглеподібний стан). Наприклад, перехід із золю в гель спостерігається під час охолодження драглів. Білки опірних тканин лише набухають і можуть зв’язувати воду в набагато більших кількостях, ніж їх маса.
практично всі білки погано кристалізуються.
Структура білкових молекул вивчалася видатними хіміками:
О.Я. Данілевський (1888 – 1891) – український хімік; Е.Фішер (1899 – 1919) – німецький хімік-органік; М.Д.Зелінський (1906 – 1934) – російський хімік-органік; Л.Полінг (1946 – 1951) – американський фізик і хімік.
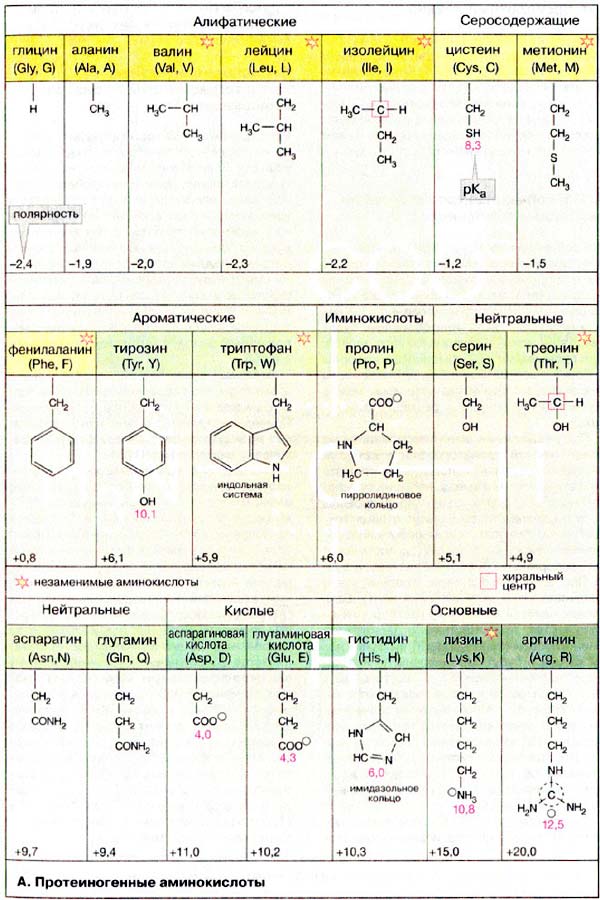
Головними структурними одиницями, які формують білкову молекулу, є 20 амінокислот, 2 аміди (аспарагін і глютамін) і 2 імінокислоти (пролін і оксипролін).
Протеїногенні амінокислоти (α-амінокислоти) утворюють пептиди і білки.