
- •II. Мытьё химической посуды
- •III. Стерилизация посуды
- •IV. Сушка химической посуды
- •1. Перегонка при атмосферном давлении (простая перегонка)
- •2. Перегонка при пониженном давлении (вакуум-перегонка)
- •VI. Важнейшие методы очистки газов
- •1. Получение и очистка водорода
- •2. Получение и очистка оксида углерода(IV)
- •Когда и что сделать?
- •II. Взвешивание
- •III. Перекристаллизация
- •Когда и что сделать?
- •Лабораторная работа № 3 «скорость химических реакций. Химическое равновесие»
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
- •Лабораторная работа № 4 «Приготовление раствора кислоты с заданным значением молярной концентрации эквивалентов и определение её точного значения методом титрования»
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
- •Лабораторная работа № 5 «равновесия в растворах электролитов»
- •Опыт № 1. Изучение характера диссоциации гидроксидов металлов
- •Опыт № 2. Смещение ионного равновесия в растворе уксусной кислоты (демонстрационный)
- •Опыт № 3. Смещение ионного равновесия в растворе аммиака кислоты (демонстрационный)
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
- •Лабораторная работа № 6 «гидролиз солей»
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
- •Лабораторная работа № 7 «окислительно-восстановительные реакции»
- •1. Окислительные свойства перманганата калия kMnO4 в различных cредах (кислой, нейтральной и щелочной)
- •2. Окислительно-восстановительные свойства пероксида водорода
- •3. Внутримолекулярное окисление-восстановление
- •4. Диспропорционирование и конпропорционирование
- •5. Окислительно-восстановительные свойства органических соединений.
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
- •Лабораторная работа № 8 «комплексные соединения (кс)»
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
Когда и что сделать?
Дома перед занятием:
Изучите содержание лабораторной работы, подготовьтесь к опросу по данному материалу.
В тетради для лабораторных работ сделайте заготовку отчёта о выполнении работы. В начале отчёта укажите дату, номер работы и её название. После этого перепишите в тетрадь названия и методики выполнения опытов из вышеприведенной «Экспериментальной части», оставляя места для записи наблюдений, объяснений, расчётов, ответов на вопросы и выводов.
На занятии:
Выполните экспериментальную часть работы, строго следуя инструкции и тщательно записывая промежуточные результаты в отчёт.
Уберите своё рабочее место.
Дома после занятия:
Выполните необходимые расчёты и запишите их в отчёт. Постройте график.
Ответьте письменно в тетради для лабораторных работ на контрольные вопросы:
Дайте определение скорости гомогенной химической реакции. Каковы её физический смысл и единицы?
Перечислите факторы, влияющие на величину скорости химических реакций.
Какова зависимость скорости химических реакций от концентраций реагентов? Как называется соответствующий закон, определяющий эту зависимость? Как он формулируется?
Какова зависимость скорости химических реакций от температуры? Каков физический смысл коэффициента скорости реакции? От каких факторов зависит его величина?
Что такое катализаторы? Какие вещества могут выступать в роли катализаторов? Как можно объяснить их влияние на скорость реакций?
Какое состояние системы называется химическим равновесием? Сформулируйте принцип Ле Шателье.
Каково влияние концентраций исходных веществ и продуктов реакции на состояние химического равновесия в системе?
Каково влияние температуры на состояние химического равновесия в гомогенной системе?
=======================================================================
Лабораторная работа № 4 «Приготовление раствора кислоты с заданным значением молярной концентрации эквивалентов и определение её точного значения методом титрования»
Т е о р е т и ч е с к а я ч а с т ь
Молярная концентрация эквивалентов вещества в объёмном анализе. Титрование.
Молярная концентрация эквивалентов вещества Х – величина, равная отношению химического количества эквивалентов вещества Х к объёму раствора:
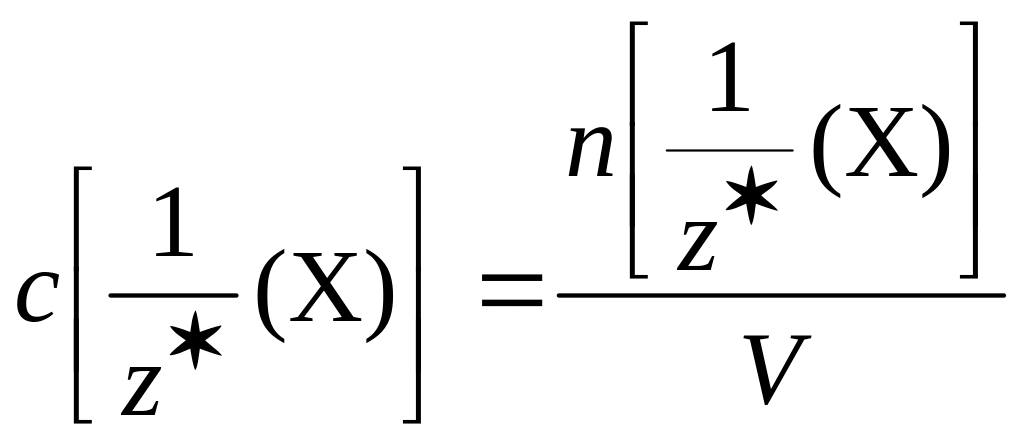 .
.
Она показывает, какое химическое
количество эквивалентов вещества Х
содержится в растворе объёмом 1 дм3.
Например, запись![]() = 0,2 моль/дм3 обозначает, что в
данном растворе объёмом 1 дм3
количество эквивалентов серной кислоты
равно 0,2 моль. Часто молярную концентрацию
эквивалента называют эквивалентной
концентрацией и обозначают символом
«сэ». Раньше её называли
нормальной концентрацией (или
нормальностью) и обозначили символами
«н» или «N».
= 0,2 моль/дм3 обозначает, что в
данном растворе объёмом 1 дм3
количество эквивалентов серной кислоты
равно 0,2 моль. Часто молярную концентрацию
эквивалента называют эквивалентной
концентрацией и обозначают символом
«сэ». Раньше её называли
нормальной концентрацией (или
нормальностью) и обозначили символами
«н» или «N».
Согласно закону эквивалентов, вещества X и Y реагируют в таком соотношении, что количество эквивалентов вещества Х всегда равно количеству эквивалентов вещества Y, т. е.:
![]() =
=
![]() .
.
Поскольку
![]() ,
а
,
а
![]() ,
,
то можно записать:
![]() =
=![]()
или в упрощенном виде:
-
Vр-ра(Х) сэ(Х) = Vр-ра(Y) сэ(Y)
Из этого уравнения видно, что при одинаковых концентрациях эквивалентов реагирующих веществ X и Y объёмы их растворов будут также одинаковыми. Так, например, для нейтрализации серной кислоты, содержащейся в растворе объёмом 50 см3 с концентрацией её эквивалентов, равной 0,1 моль/дм3, требуется такой же объём раствора гидроксида натрия с концентрацией его эквивалентов, равной 0,1 моль/дм3. Если же молярные концентрации эквивалентов веществ X и Y не равны между собой, то их отношение обратно пропорционально отношению объёмов растворов этих веществ:
|
Это уравнение позволяет рассчитать значение эквивалентной концентрации вещества Х, если известно значение концентрации реагирующего с ним вещества Y. Данный тип расчетов очень широко используется в аналитической химии и лежит в основе метода объёмного анализа, основанного на измерении объёмов растворов реагирующих веществ.
На практике для определения эквивалентной концентрации веществ используют метод титровáния (от франц. «titre» – количество). Он заключается в том, что к определённому объёму раствора с неизвестной эквивалентной концентрацией вещества Х постепенно добавляют раствор с известной концентрацией вещества Y до момента окончания реакции, которому соответствует изменение окраски индикатора. Определив таким образом точный объём добавленного раствора вещества Y, рассчитывают эквивалентную концентрацию вещества Х в исходном растворе.
Пример 1.
На титрование раствора гидроксида калия объемом 10,0 см3 израсходован раствор объемом 12,8 см3 с эквивалентной концентрацией серной кислоты, равной 0,1200 моль/дм3. Вычислить эквивалентную концентрацию щёлочи в исходном растворе.
Решение:
Из уравнения V(кисл) сэ(кисл) = V(щёл) сэ(щёл)
выразим искомую концентрацию и найдем её значение:
сэ(щёл) =
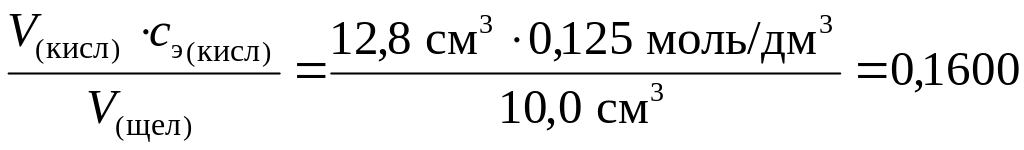 моль/дм3.
моль/дм3.
При приготовлении растворов с заданными значениями молярной концентрации эквивалентов необходимо помнить, что молярная масса эквивалента одного и того же вещества может иметь разные значения в зависимости от того, в какой реакции это вещество будет участвовать. Например, для реакции H2SO4 + NaOH NaHSO4 + H2O эквивалентом кислоты является её молекула и молярная масса эквивалентов равна 98 г/моль. В случае же другой реакции: H2SO4 + 2NaOH Na2SO4 + 2H2O эквивалентом кислоты является половина её молекулы и молярная масса эквивалентов в этом случае составляет:
M![]() .
.
Э к с п е р и м е н т а л ь н а я ч а с т ь
ОПЫТ 1. Определение плотности исходного раствора и массовой доли кислоты в нём
Для быстрого определения плотности растворов используют специальные приспособления – ареόметры. Ареόметр представляет собой изготовленный в виде поплавка стеклянный сосуд со шкалой, градуированный в единицах плотности (кг/м3) (рис. 1).
Рис.1. Ареометр.
1 – шарик со
свинцовой дробью; 2 – стеклянная ампула;
3 - шкала
Выполнение:
1) Исходный раствор кислоты налейте в сухой цилиндр на 2/3 его объема. Осторожно опустите в этот раствор ареометр и следите за тем, чтобы он не касался дна и стенок цилиндра, а нижний мениск жидкости в цилиндре располагался бы в пределах шкалы ареометра (рис. 2).
2
Рис. 2. Измерение
плотности раствора ареометром
3) Запишите найденное значение плотности в отчёт. Используя справочную таблицу 1, определите массовую долю кислоты, соответствующую найденному значению плотности.
Таблица 1.
Массовые доли кислот и соответствующие им значения плотности растворов (г/см3).
Массовая доля кислоты, (%) |
Плотность растворов кислот, г/см3 (20 оС) |
||
H2SO4 |
HNO3 |
HCl |
|
6 |
1,040 |
1,033 |
1,029 |
7 |
1,045 |
1,037 |
1,037 |
8 |
1,052 |
1,044 |
1,039 |
9 |
1,059 |
1,049 |
1,043 |
10 |
1,066 |
1,056 |
1,049 |
12 |
1,080 |
1,068 |
1,059 |
14 |
1,098 |
1,080 |
1,069 |
16 |
1,112 |
1,093 |
1,079 |
18 |
1,127 |
1,106 |
1,083 |
20 |
1,143 |
1,119 |
1,100 |
22 |
1,158 |
1,132 |
1,110 |
24 |
1,174 |
1,145 |
1,121 |
26 |
1,190 |
1,158 |
1,132 |
28 |
1,205 |
1,171 |
1,142 |
30 |
1,224 |
1,184 |
1,152 |
Пример 2 .
Определим с помощью справочной таблицы массовую долю серной кислоты в растворе с плотностью, равной 1,200 г/см3 , если в таблице приведены значения плотности, равные 1,190 г/см3 и 1,205 г/см3 , которым соответствуют массовые доли кислоты 26 % и 28 %.
Решение:
а) Находим разность между бóльшим и меньшим табличными значениями плотности, ближайшими к значению 1,200 г/см3:
= (больш) – (меньш) = 1,205 – 1,190 = 0,015.
б) Находим разность между табличными значениями массовых долей кислоты, соответствующими данным значениям плотности:
w = w(больш) – w(меньш) = 28 % – 26 % = 2 %.
в) Находим разность между измеренным значением плотности и меньшим её табличным значением:
1 = (измер) – (меньш) = 1,200 – 1,190 = 0,010.
г) Составим пропорцию и находим значение w1 , соответствующее найденному значению 1 :
если = 0,015, то w = 2 %,
если 1 = 0,010, то w1 = х %,
откуда х = 1,3 %.
д) Находим искомое значение массовой доли кислоты, добавив найденное w1 к меньшему табличному значению массовой доли:
w(кисл) = 26 % + 1,3 % = 27,3 %.
По приведенному образцу рассчитайте массовую долю кислоты в приготовленном растворе и запишите её в отчёт.
ОПЫТ 2. Приготовление раствора
Выполнение:
Расчет объёма исходного раствора кислоты:
а) Исходя из величин объёма раствора и молярной концентрации эквивалентов кислоты, указанных в задании, рассчитайте массу кислоты, которая будет содержаться в приготовленном растворе.
б) Исходя из массы кислоты и массовой доли ее в исходном растворе, рассчитайте массу этого раствора.
в) Исходя из массы исходного раствора и его плотности, рассчитайте объём данного раствора.
Приготовление раствора:
а) Мерную колбу указанного объёма наполните примерно наполовину дистиллированной водой.
б) Отмерьте рассчитанный объём исходного раствора кислоты узким мерным цилиндром.
в) Осторожно перелейте через воронку отмеренный объём раствора в мерную колбу с водой и перемешайте ее содержимое круговыми движениями. Аккуратно долейте в колбу дистиллированную воду, доведя уровень нижнего мениска жидкости до метки на горлышке колбы. При этом последние порции воды добавляйте по каплям. Закройте колбу и, удерживая пробку, тщательно перемешайте раствор, несколько раз перевернув колбу вверх дном.
ОПЫТ 3. Определение концентрации кислоты в приготовленном растворе.
Выполнение (состоит из 3-х частей):
1) П о д г о т о в к а б ю р е т к и к р а б о т е
а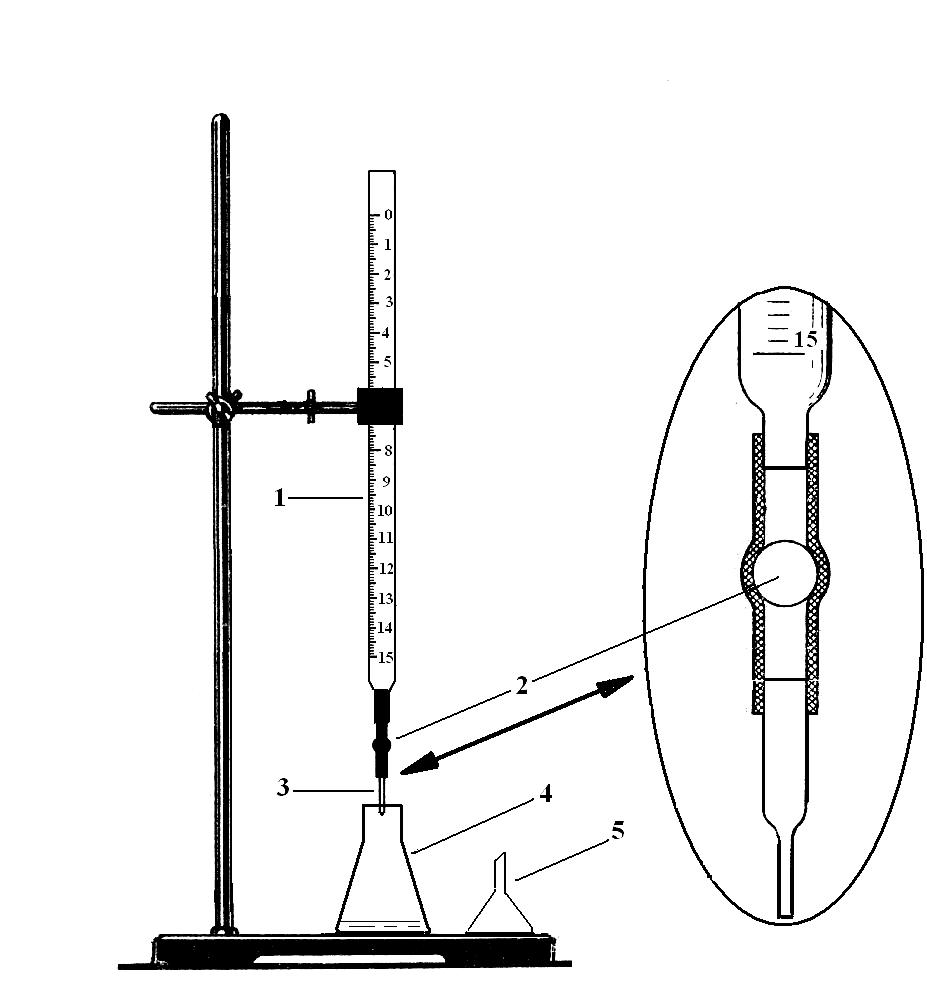 )
Соберите прибор для титрования (рис.
3). Бюретку закрепите строго вертикально
над основанием штатива. При этом шкала
бюретки должна быть обращена к вам.
Высоту бюретки отрегулируйте так, чтобы
ее капилляр был на 0,5 – 1 cм
ниже горлышка колбы для титрования,
стоящей на основании штатива.
)
Соберите прибор для титрования (рис.
3). Бюретку закрепите строго вертикально
над основанием штатива. При этом шкала
бюретки должна быть обращена к вам.
Высоту бюретки отрегулируйте так, чтобы
ее капилляр был на 0,5 – 1 cм
ниже горлышка колбы для титрования,
стоящей на основании штатива.
б
Рис. 3. Прибор для
титрования.
1 – бюретка; 2 –
резиновая трубка со стеклянным шариком;
3 – стеклянный капилляр; 4 –колба для
титрования; 5 – химическая воронка.
в) Промойте бюретку. Для этого слейте из нее раствор кислоты через капилляр в стакан. Промытую бюретку снова заполните раствором кислоты примерно до нулевого деления и удалите из капилляра бюретки пузырьки воздуха. Для этого капилляр поднимите вверх и сливайте раствор из бюретки в стакан до тех пор, пока он не вытеснит из капилляра все пузырьки воздуха (рис. 4).
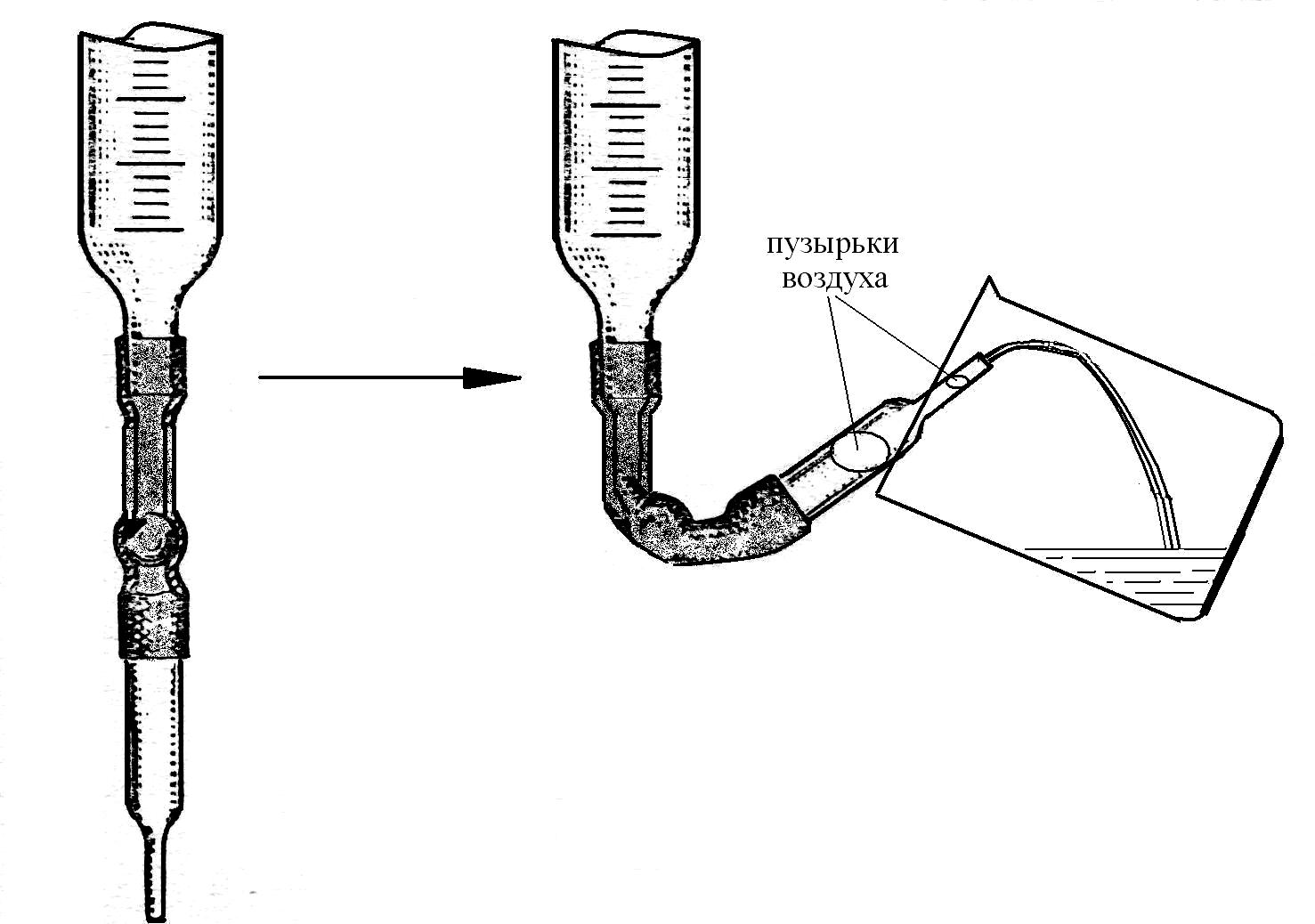
Рис. 4. Удаление
пузырьков воздуха из капилляра бюретки
г) Установите уровень жидкости в бюретке на нулевом делении. Для этого долейте в бюретку из мерной колбы столько раствора, чтобы его уровень был выше отметки «0» примерно на 1 см. Затем, убрав с бюретки воронку (!!!), осторожно, по каплям (!!!) сливайте раствор в стакан, пока нижний мениск жидкости в бюретке не совпадет с делением «0».
2. Т и т р о в а н и е
а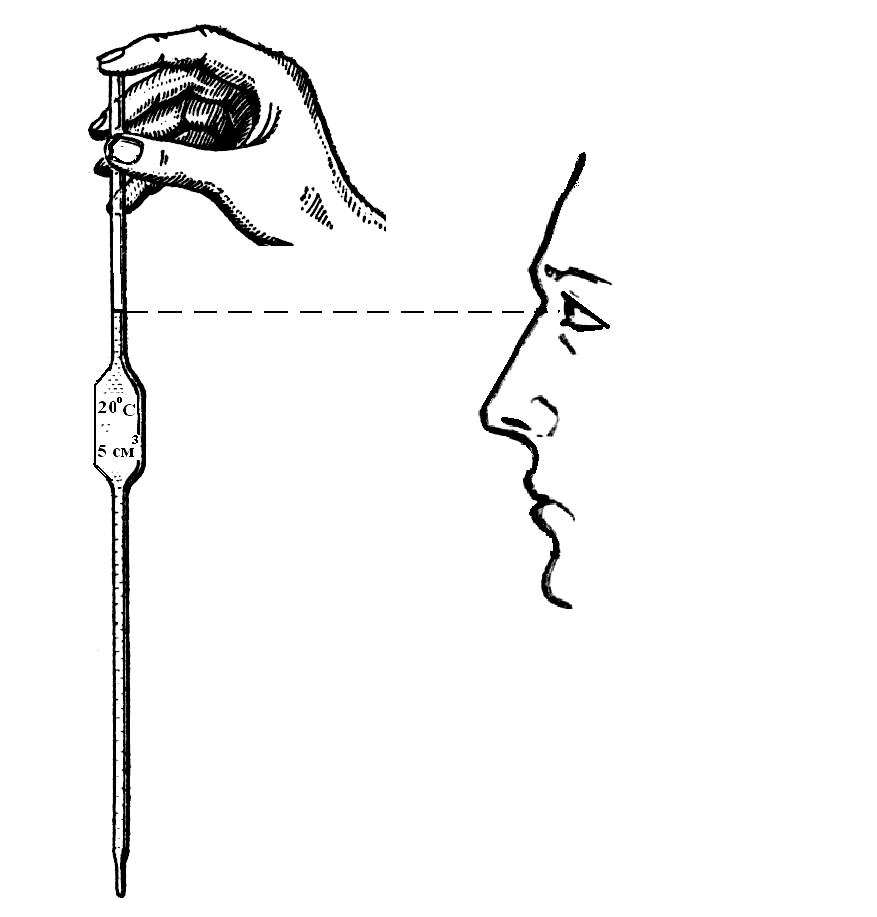 )
В колбу для титрования отмерьте с помощью
пипетки строго определенный объём
(аликвóту) раствора щёлочи (5 или 10 см3)
с известной эквивалентной концентрацией
(0,1 моль/дм3). Для этого, держа
пипетку большим и средним пальцами,
опустите её на максимальную глубину в
раствор щёлочи. Осторожно затягивая
воздух из пипетки резиновой грушей,
наберите в пипетку столько раствора,
чтобы его уровень оказался выше метки
на 1 – 1,5 см. Затем быстро, не извлекая
пипетку из раствора, закройте её
указательным пальцем. Колбу с раствором
и пипеткой поднимите до такой высоты,
чтобы метка оказалась на уровне ваших
глаз (рис. 5).
)
В колбу для титрования отмерьте с помощью
пипетки строго определенный объём
(аликвóту) раствора щёлочи (5 или 10 см3)
с известной эквивалентной концентрацией
(0,1 моль/дм3). Для этого, держа
пипетку большим и средним пальцами,
опустите её на максимальную глубину в
раствор щёлочи. Осторожно затягивая
воздух из пипетки резиновой грушей,
наберите в пипетку столько раствора,
чтобы его уровень оказался выше метки
на 1 – 1,5 см. Затем быстро, не извлекая
пипетку из раствора, закройте её
указательным пальцем. Колбу с раствором
и пипеткой поднимите до такой высоты,
чтобы метка оказалась на уровне ваших
глаз (рис. 5).
б
Рис. 5. Отмеривание
определённого объёма раствора пипеткой
в) Пипетку с раствором перенесите в колбу для титрования так, чтобы капилляр пипетки касался её стенки и отпустите палец, закрывающий пипетку, при этом раствор из пипетки перельется в колбу. После этого дотроньтесь 2 – 3 раза капилляром до поверхности раствора в колбе. Это необходимо для того, чтобы объём раствора, вытекшего из пипетки, точно соответствовал отмеренному объёму.
г) В колбу с раствором щёлочи добавьте 1 каплю раствора фенолфталеина и проведите ориентировочное титрование. Для этого, постоянно перемешивая содержимое колбы круговыми движениями, добавляйте в неё по каплям раствор из бюретки и внимательно следите за изменением окраски раствора. Когда ее интенсивность начнет ослабевать, уменьшите скорость добавления капель и тщательно перемешивайте раствор в колбе после добавления каждой капли. Титрование закончите лишь тогда, когда раствор в колбе полностью обесцветится.
д) Определите объем израсходованного на титрование раствора кислоты, произведя отчет по шкале бюретки сверху вниз (по нижнему мениску !). Запишите полученное значение объема раствора кислоты V1, израсходованного на ориентировочное титрование:
V1 = … см3.
е) Повторите титрование 3 – 4 раза, каждый раз используя новую сухую колбу и устанавливая уровень раствора в бюретке на нулевом делении. Запишите полученные значения объемов раствора кислоты:
V2 = … см3; V3 = … см3; V4 = … см3.
Помните, что они могут различаться не более чем на 0,1 см3.
3. Р а с ч ё т м о л я р н о й к о н ц е н т р а ц и и э к в и в а л е н т о в к и с л о т ы в
п р и г о т о в л е н н о м р а с т в о р е
а) Из сходящихся (различающихся
не более, чем на 0,1 см3) значений
объёмов раствора кислоты, израсходованных
на титрование, рассчитайте среднее
значение объёма и запишите его в отчет:
Vср.(кисл) =
![]() =
… (см3).
=
… (см3).
б) Рассчитайте молярную концентрации
эквивалентов кислоты в приготовленном
растворе и запишите в отчет: сэ(кисл.)
=
![]() = … моль/дм3.
= … моль/дм3.
в) Рассчитайте относительную ошибку приготовления раствора кислоты:
=
 = … %.
= … %.
