
- •II. Мытьё химической посуды
- •III. Стерилизация посуды
- •IV. Сушка химической посуды
- •1. Перегонка при атмосферном давлении (простая перегонка)
- •2. Перегонка при пониженном давлении (вакуум-перегонка)
- •VI. Важнейшие методы очистки газов
- •1. Получение и очистка водорода
- •2. Получение и очистка оксида углерода(IV)
- •Когда и что сделать?
- •II. Взвешивание
- •III. Перекристаллизация
- •Когда и что сделать?
- •Лабораторная работа № 3 «скорость химических реакций. Химическое равновесие»
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
- •Лабораторная работа № 4 «Приготовление раствора кислоты с заданным значением молярной концентрации эквивалентов и определение её точного значения методом титрования»
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
- •Лабораторная работа № 5 «равновесия в растворах электролитов»
- •Опыт № 1. Изучение характера диссоциации гидроксидов металлов
- •Опыт № 2. Смещение ионного равновесия в растворе уксусной кислоты (демонстрационный)
- •Опыт № 3. Смещение ионного равновесия в растворе аммиака кислоты (демонстрационный)
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
- •Лабораторная работа № 6 «гидролиз солей»
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
- •Лабораторная работа № 7 «окислительно-восстановительные реакции»
- •1. Окислительные свойства перманганата калия kMnO4 в различных cредах (кислой, нейтральной и щелочной)
- •2. Окислительно-восстановительные свойства пероксида водорода
- •3. Внутримолекулярное окисление-восстановление
- •4. Диспропорционирование и конпропорционирование
- •5. Окислительно-восстановительные свойства органических соединений.
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
- •Лабораторная работа № 8 «комплексные соединения (кс)»
- •Когда и что сделать?
- •На занятии:
- •Дома после занятия:
Когда и что сделать?
Дома перед занятием:
Изучите содержание лабораторной работы, подготовьтесь к опросу по данному материалу.
В тетради для лабораторных работ сделайте заготовку отчёта о выполнении работы. В начале отчёта укажите дату, номер работы и её название. После этого перепишите в тетрадь названия и методики выполнения опытов из вышеприведенной «Экспериментальной части», оставляя места для записи наблюдений, объяснений, расчётов, ответов на вопросы и выводов.
На занятии:
Выполните экспериментальную часть работы, строго следуя инструкции и тщательно записывая промежуточные результаты в отчёт.
Уберите своё рабочее место.
Дома после занятия:
Выполните задания ко всем опытам. Проведите необходимые расчёты и запишите их в отчёт.
Ответьте письменно в тетради для лабораторных работ на контрольные вопросы:
Чем определяется способность солей к гидролизу? Какие соли не гидролизуются?
Взаимодействие между какими частицами лежит в основе гидролиза солей?
В каких случаях соли гидролизуются обратимо, а в каких – необратимо? Приведите по два примера соответствующих солей.
В чём заключается совместный гидролиз двух солей?
Что характеризует константа гидролиза соли? Как она рассчитывается? От каких факторов зависит её величина?
Что характеризует степень гидролиза соли? Как она связана с константой гидролиза? От каких факторов зависит величина степени гидролиза?
Почему среда раствора Na2HPO4 щёлочная, а среда раствора KH2PO4 – кислая?
Как можно на практике ослабить гидролиз соли; усилить его?
=====================================================
Лабораторная работа № 7 «окислительно-восстановительные реакции»
Т е о р е т и ч е с к а я ч а с т ь
1. Окислительные свойства перманганата калия kMnO4 в различных cредах (кислой, нейтральной и щелочной)
Перманганат калия KMnO4 – один из наиболее распространенных сильных окислителей, широко использующийся в химической промышленности, в лабораторной практике и в медицине. Состав продуктов его восстановления зависит, прежде всего, от среды растворов, в которых оно осуществляется. При этом, как правило:
1) В кислой среде KMnO4
восстанавливается до соединений
![]() (MnSO4, MnCl2):
(MnSO4, MnCl2):
![]() + 5e–
→
или
+ 5e–
→
или
![]() + 8H+
+ 5e–
→
+
4H2O;
E°
= 1,51 B.
+ 8H+
+ 5e–
→
+
4H2O;
E°
= 1,51 B.
2) В нейтральной среде KMnO4
восстанавливается до соединений
![]() ,
состав которых условно выражается
формулой MnО2:
,
состав которых условно выражается
формулой MnО2:
+ 3e– → или + 2H2О + 3e– → MnО2 + 4ОH—; E° = 0,60 B.
3) В щелочной среде KMnO4
восстанавливается до соединений
![]() (K2MnO4,
Na2MnO4):
(K2MnO4,
Na2MnO4):
+ 1e–
→
![]() или
+ 1e–
→
или
+ 1e–
→
![]() ;
E°
= 0,56 B.
;
E°
= 0,56 B.
При этом происходит резкое изменение окраски растворов в соответствии с данными таблицы 1:
Таблица 1. Окраска соединений марганца в зависимости от степени его окисления
-
Степень окисления марганца
Форма существования в растворе или в осадке
Примеры соединений
Окраска раствора
или осадка
+7
(р-р)
KMnO4, NaMnO4
розово-фиолетовая
+6
(р-р)
K2MnO4, Na2MnO4
изумрудно-зелёная
+4
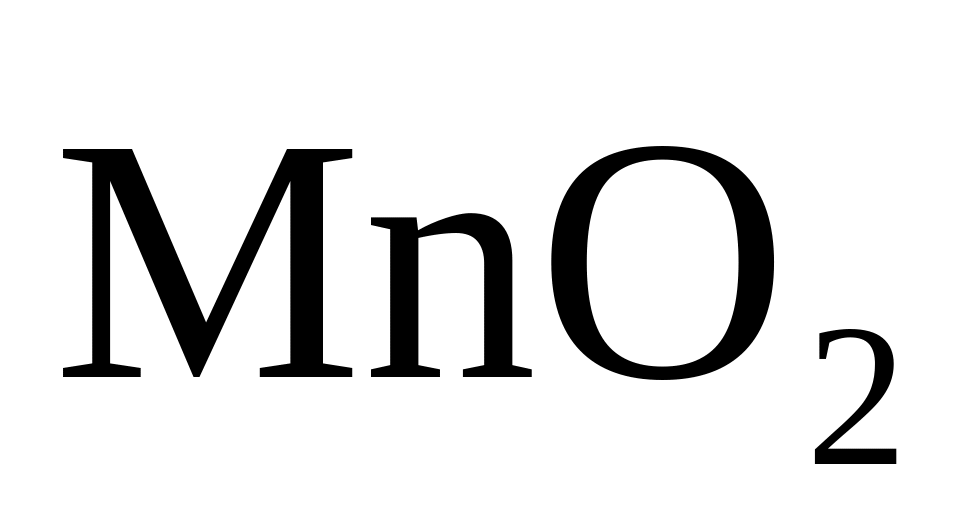 (осадок)
(осадок)MnО2
бурая
+2
(р-р)
MnSO4, MnCl2
практич. бесцветная
