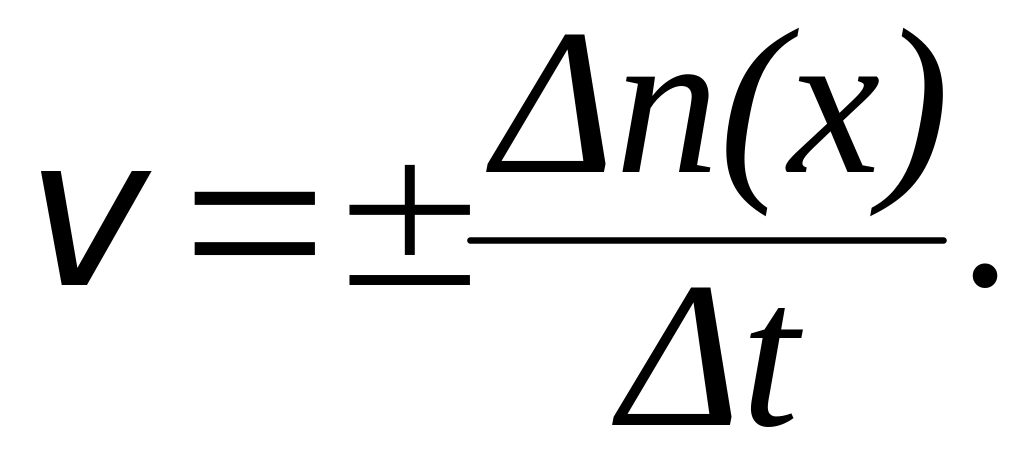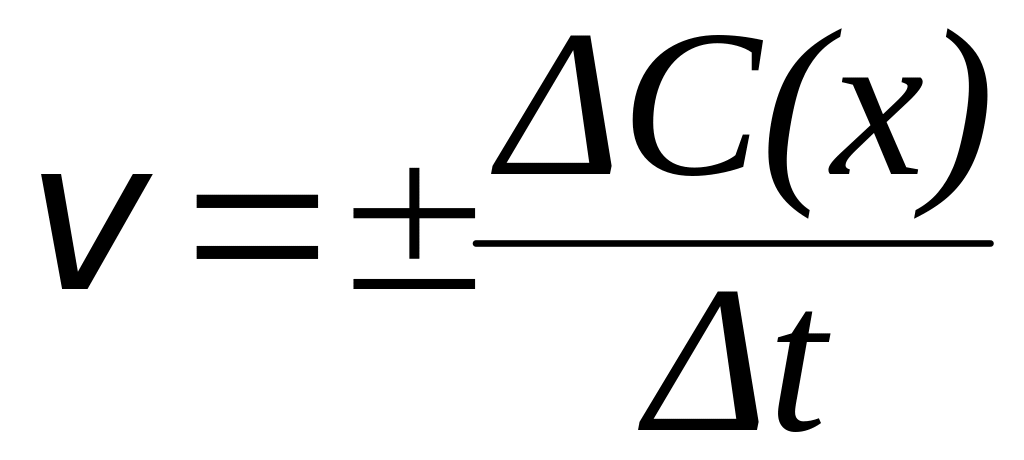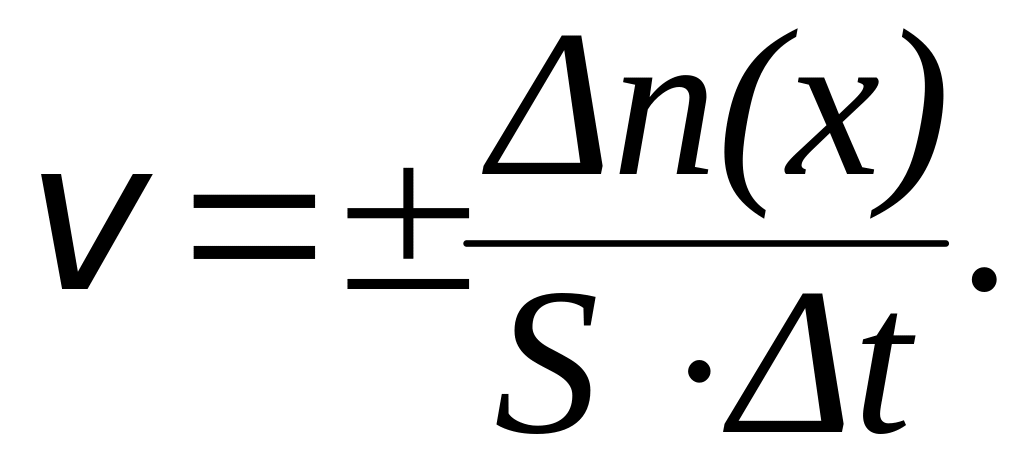- •Энергетика химических реакций
- •Основы термодинамики
- •Термохимические уравнения и расчеты
- •I следствие:
- •II следствие:
- •Направление протекания химических реакций
- •Эталоны решения задач
- •2C2h5oh(жидк.) c2h5oc2h5(жидк.) h2o(жидк.)
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •2H2s(газ) o2(газ) 2h2o(жидк.) 2s(тв.);
- •2S(тв.) 3o2(газ) 2h2o(жидк.) 2h2so4(жидк.),
- •4HCl(газ) o2(газ) 2Cl2(газ) 2h2o(жидк.)
- •Вариант №5
- •2Ch3Cl(газ) 3o2(газ) 2co2(газ) 2h2o(жидк.) 2hCl(газ),
- •Вариант №6
- •Вариант №7
- •2) C6h12o6(кр.) 6o2(газ) 6co2(газ) 6h2o(жидк.).
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •2H2o(жидк.) o2(газ) 2h2o2(жидк.),
- •Вариант №17
- •3Hno2(водн. Р-р) hno3(жидк.) 2no(газ) h2о(жидк.),
- •Вариант №18*
- •4Nh3(газ) 3o2(газ) 2n2(газ) 6h2o(жидк.)
- •3C2h2(газ) c6h6(жидк.)
- •Скорость химических реакций
- •Основы химической кинетики Факторы, влияющие на скорость химической реакции
- •1. Зависимость скорости реакции от концентраций реагентов.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергия активации
- •Порядок и молекулярность реакции
- •Реакции I порядка
- •Механизмы протекания химических реакций
- •I закон фотохимии:
- •II закон фотохимии:
- •Фотосинтез
- •6Co2 6h2o c6h12o6 6o2 g0 2861,9 кДж/моль.
- •Ферментативный катализ
- •Эталоны решения задач
- •2 Моль/л a 1 моль/л b
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант № 15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Химическое равновесие
- •Термодинамика равновесных процессов
- •Кинетика равновесных процессов
- •Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задачи для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Растворы Общие сведения
- •Теории растворов
- •1. Физическая теория растворов.
- •2. Химическая теория растворов.
- •Основные способы выражения концентрации растворов
- •Связь между различными способами
- •Эталоны решения задач
- •4) Приготовление раствора аналогично задаче №6.
- •Вопросы для самоконтроля
2H2o(жидк.) o2(газ) 2h2o2(жидк.),
если
|
H2O2 |
H2O |
O2 |
, кДж/моль |
188 |
286 |
0 |
, Дж/(мольK) |
110 |
70 |
205 |
Вариант №17
1. Синтез-газ представляет собой смесь равных объемов водорода и оксида углерода (II). Вычислить количество энергии, которое выделится при сжигании 112 л синтез-газа, если известны термохимические уравнения:
СO(газ) O2(газ) CO2(газ) H0 283 кДж;
H2(газ) O2(газ) H2O(жидк.) H0 286 кДж.
2. Вычислить стандартную энтропию реакции:
3Hno2(водн. Р-р) hno3(жидк.) 2no(газ) h2о(жидк.),
по известным данным:
|
HNO2 |
HNO3 |
NO |
H2O |
, Дж/(мольK) |
153 |
155 |
210 |
70 |
3. Определить температуру, при которой самопроизвольно будет протекать реакция:
CO(газ) 2H2(газ) CH3OH(жидк.),
если: 128 кДж; 333 кДж/K.
Вариант №18*
1. В ходе реакции окисления аммиака
4Nh3(газ) 3o2(газ) 2n2(газ) 6h2o(жидк.)
образовалось
2,24 л азота и при этом выделилось 76,5 кДж
теплоты. Вычислить
![]() NH3,
если
H2O
286
кДж/моль.
NH3,
если
H2O
286
кДж/моль.
2. Рассчитать стандартную энтальпию реакции:
3C2h2(газ) c6h6(жидк.)
по следующим данным:
2C2H2(газ) 5O2(газ) 4CO2(газ) 2H2O(жидк.) H0 2600 кДж;
C6H6(газ) 7,5O2(газ) 6CO2(газ) 3H2O(жидк.) H0 3302 кДж;
3. Константа диссоциации уксусной кислоты равна 1,8105. Вычислить изменение энергии Гиббса при диссоциации уксусной кислоты.
БЛОК ИНФОРМАЦИИ
Скорость химических реакций
Математический аппарат химической термодинамики позволяет определять тепловые эффекты химических реакций и прогнозировать направление протекания процессов, но при этом важнейшая для практики величина время, за которое протекает процесс не рассматривается в рамках классической термодинамики.
Раздел химии, изучающий скорости и механизмы химических процессов, называется химической кинетикой.
Знание законов химической кинетики необходимо врачу, чтобы:
1) глубже понимать суть процессов, протекающих в организме;
2) определять оптимальные промежутки времени между приемами лекарственного средства;
3) оценивать остаточное количество токсиканта в организме.
Основы химической кинетики Факторы, влияющие на скорость химической реакции
Основная величина
в химической кинетике
скорость реакции. В общем случае,
скорость химической реакции /![]() /
определяется изменением количества
реагирующего вещества в единицу времени:
/
определяется изменением количества
реагирующего вещества в единицу времени:
|
(1) |
Для гомогенной (однородной) системы средняя скорость химической реакции измеряется количеством веществ, вступивших в реакцию или образующихся в результате реакции за единицу времени в единице объема системы. Иными словами, в данном случае скорость реакции определяется изменением концентраций реагирующих веществ в единицу времени:
|
(2) |
Истинная скорость гомогенной реакции, т.е., скорость реакции в данный момент времени, рассчитывается по уравнению:
|
(3) |
Концентрации реагирующих веществ принято выражать в моль/л, а время – в секундах, минутах или часах. Если время измерять в секундах, то размерность скорости гомогенной реакции: [моль∙л1∙с1].
Для гетерогенной (неоднородной) системы скорость химической реакции измеряется количеством веществ, вступивших в реакцию или образующихся в результате реакции за единицу времени на единице поверхности раздела фаз:
|
(4) |
Размерность скорости гетерогенной реакции: [моль∙м–2∙с–1].
Скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. В некоторых случаях на скорость реакции оказывают влияние давление (если реакция протекает в газовой фазе), природа растворителя (если реакция протекает в растворе) и вид излучения (солнечная энергия, радиоактивное излучение). Скорость гетерогенных реакций зависит также от площади поверхности соприкосновения реагирующих веществ.