
- •Раздел 1. Сущность титриметрического анализа
- •1.1 Приготовление стандартных растворов
- •1.2. Основные приемы титрования
- •1.3. Расчеты в титриметрическом анализе
- •1.3.1. Расчет результата прямого титрования при разном способе выражения концентрации раствора
- •1.3.2. Расчет результата в методах обратного титрования
- •1.4. Кривые титрования
- •1.5. Основные методы титриметрического анализа
- •1.6. Порядок титрования
- •Раздел 2. Кислотно-основное титрование (метод нейтрализации)
- •2.1. Приготовление и стандартизация раствора соляной кислоты
- •2.2. Определение нормальности раствора щелочи с помощью раствора соляной кислоты
- •2.3. Определение карбонатной жесткости воды
- •2.4. Определение гидроксида и карбоната натрия при совместном присутствии в растворе.
- •Раздел 3. Перманганатометрическое титрование
- •3.1. Сущность перманганатометрического титрования.
- •3.2. Приготовление стандартизированного раствора перманганата калия.
- •3.3. Определение железа в растворе соли Мора.
- •Раздел 4. Дихроматометическое титрование
- •4.1. Сущность дихроматометрического титрования.
- •Indокисл → Indвосст – ne-
- •4.2. Приготовление стандартного раствора дихромата калия.
- •4.3. Определение содержания железа (II) в растворе.
- •Раздел 5. Методы осадительного титрования
- •5.1. Сущность осадительного титрования.
- •5.2. Аргентометрическое титрование.
- •5.3. Тиоцианометрическое титрование.
- •5.4. Приготовление стандартизированного раствора нитрата серебра
- •5.5. Определение содержания хлора в образце по Мору
- •5.6. Приготовление стандартизированного раствора тиоцианата аммония
- •5.7. Определение содержания хлора в образце по Фольгарду
- •Раздел 6. Комплексонометрическое титрование
- •6.1 Сущность метода.
- •6.2. Индикаторы хелатометрического титрования
- •6.3. Способы хелатометрического титрования
- •6.4. Определение общей жесткости воды
- •6.5. Определение примесей магния в калийных удобрениях
- •Раздел 7. Контрольные вопросы и задачи
- •Количественный химический анализ титриметрический анализ
1.3.2. Расчет результата в методах обратного титрования
Рассмотрим расчет результата на примере обратного титрования хлорида. В этом методе к анализируемому раствору хлорида добавляется заведомый избыток титрованного раствора AgNO3 , и не вступившее в реакцию с хлоридом количество вещества AgNO3 оттитровывается раствором NH4SCN. Если n (AgNO3 ) – количество вещества AgNO3, добавленное к анализируемому раствору хлорида, n (AgCl) – количество вещества эквивалента AgNO3, израсходованное на реакцию с хлоридом, а n (AgSCN) на реакцию с тиоцианатом, то, очевидно,
n (AgNO3) = n (AgCl) + n (AgSCN). (10)
Величина n (AgNO3) определяется молярной концентрацией эквивалента основного рабочего раствора AgNO3 и его объемом
n
(AgNO3)
=
![]() (11)
(11)
Молярная концентрация эквивалента вспомогательного раствора NH4SCN и его объем, затраченный на реакцию с избытком AgNO3 после охлаждения хлорида, точно известны, поэтому
![]() (12)
(12)
Количество вещества - эквивалента хлорида в анализируемом растворе находим из уравнения (10)
n (AgCl) = n (AgNO3) – n (AgSCN)
и подставляем в это соотношение уравнения (11) и (12)
n
= (AgCl)![]()
Масса хлорида в анализируемом растворе будет равна:
m(Cl) =
n(AgCl) M(Cl) =
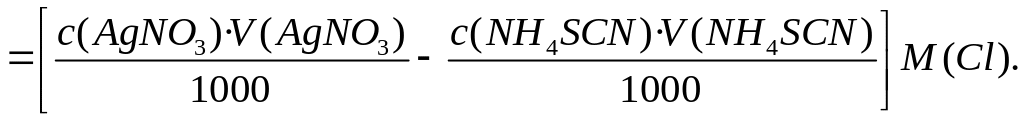 (13)
(13)
Результат обратного титрования всегда рассчитывается по разности между взятым количеством вещества - эквивалента основного рабочего вещества и оставшимся после его реакции с определяемым компонентом.
Погрешность методов обратного титрования можно рассчитать также с помощью формулы
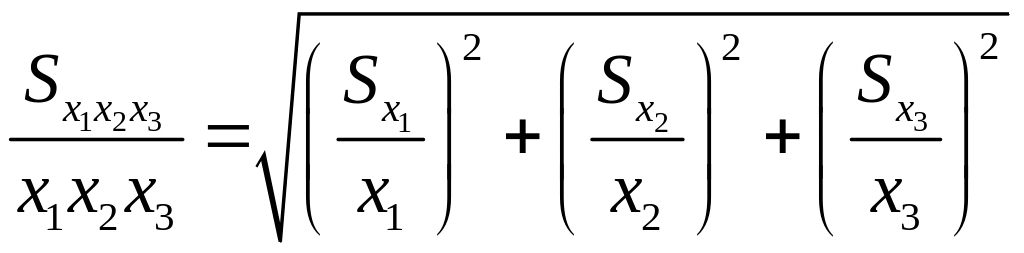 (13а)
(13а)
причем для упрощения ориентировочных расчетов примем, что концентрация обоих рабочих растворов одинакова. Тогда уравнение (13) переходит в
![]() (14)
(14)
где c = c (AgNO3) = c(NH4SCN), а ΔV =V1-V2, если V1 =V(AgNO3), V2 =V(NH4SCN). Применим к уравнению (14) формулу (13а):
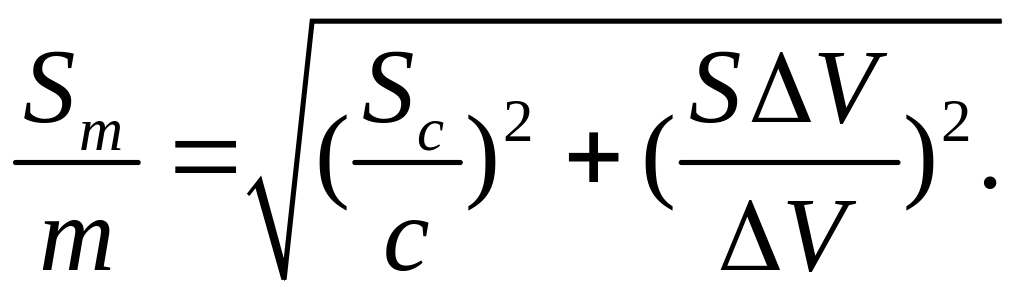 (15)
(15)
Погрешность
определения молярной концентрации
эквивалента Sc
в уравнении (15) будет зависеть от
погрешностей, с которыми определены
концентрации каждого из раствора, и по
закону сложения ошибок
![]() будет равна
будет равна
![]() (16)
(16)
где S1 и S2 – погрешности определения молярной концентрации эквивалента растворов AgNO3 и NH4SCN соответственно.
Погрешность разности объемов SΔv по закону сложения ошибок будет равна:
![]() (17)
(17)
где SV1 и SV2 –погрешности определения объемов AgNO3 и NH4SCN соответственно.
При подстановке уравнений (16) и (17) в (15) получаем
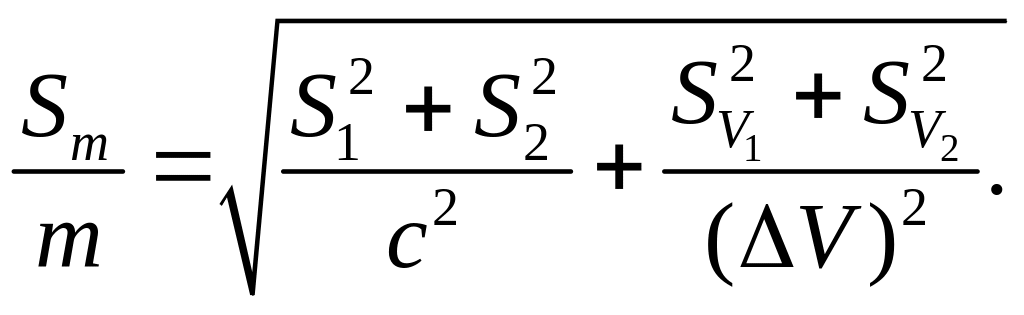 (18)
(18)
Если считать, что при работе 0,1 н растворами погрешности в определении молярной концентрации эквивалента составляет ± 0,0002, а объемы рабочих растворов определяются с погрешностью ± 0,02 мл, подстановка численных значений в уравнение (18) дает
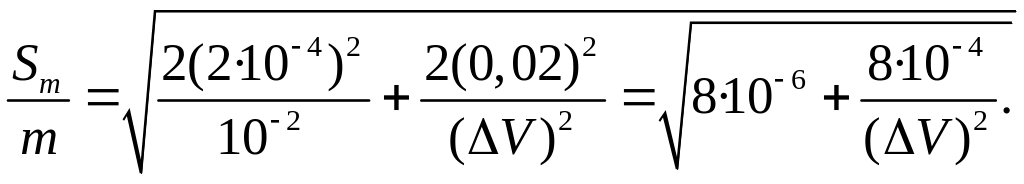 (19)
(19)
Из уравнения (19) видно, что погрешность анализа в значительной степени зависит от разности объемов рабочих растворов, использованных при титровании: с увеличением разности погрешность уменьшается. Расчет по уравнению (19) показал, что при ΔV=1,0 мл относительная погрешность анализа составляет 2,8%, при ΔV= 5,0 мл она уменьшается до 0,63%, а при ΔV= 25,0 мл – до 0,32%. Очевидно, при обратном титровании разность объемов 0,1н рабочих растворов менее10,0 мл нежелательна в связи с большой погрешностью анализа. Приведенные расчеты носят, разумеется, ориентировочный характер, так как связаны с некоторыми допущениями, и заключительная рекомендация о предельной величине ΔV=10,0 мл абсолютного значения не имеет, но окончательный вывод об увеличении погрешности анализа с уменьшением разности объемов рабочих растворов останется справедливым в любом случае.
