
- •Правила техники безопасности при работе в лаборатории аналитической химии
- •Предмет и методы аналитической химии
- •Техника качественного анализа Реактивы, посуда, аппаратура
- •Правила пользования реактивами
- •Техника выполнения важнейших операций
- •Правила работы на центрифуге
- •Общие правила работы в лаборатории аналитической химии
- •Замечания к проведению аналитических реакций
- •Аналитические реакции и реагенты, классификация катионов
- •Первая аналитическая группа катионов
- •Реакции ионов калия
- •Реакции ионов натрия
- •Реакции ионов аммония
- •Реакции ионов магния
- •Контрольные вопросы
- •Действие группового реагента (nh4)2co3
- •Действие общих реагентов
- •Фосфаты и гидрофосфаты катионов II группы растворимы в минеральных кислотах и сн3соон.
- •Реакции ионов бария
- •Это происходит по следующим причинам. В водных растворах к2Сr2о7 существует равновесие:
- •Реакции ионов стронция
- •Реакции ионов кальция
- •Контрольные вопросы
- •Третья аналитическая группа катионов
- •Действие группового реагента (nh4)2s
- •Реакции ионов железа
- •Реакции ионов марганца
- •Реакции ионов кобальта
- •Контрольные вопросы
- •Анализ смеси катионов III, II, I групп метод с применением перекиси водорода
- •1. Предварительные наблюдения и испытания
- •2. Отделение катионов III группы от II и I групп
- •3. Подготовка раствора к обнаружению катионов II и I групп
- •4. Растворение осадка сульфидов и гидрооксидов
- •10. Обнаружение и отделение CrO42-
- •Список литературы
Реакции ионов аммония
1.Едкие щелочи КОН, NaOH при нагревании разлагают соли и гидроксид аммония с выделением газообразного аммиака:
NH4Cl + KOH = NH3↑ + KCl + H2O,
NH4+ + OH- = NH3↑ + H2O.
Выполнение реакции. В пробирку помещают 2-3 капли раствора соли аммония, прибавить 1-2 капли раствора щелочи, нагреть. Выделение аммиака можно обнаружить по запаху или изменению окраски влажной индикаторной бумажки при поднесении к отверстию пробирки. Выделившийся аммиак взаимодействует с водой индикаторной бумаги, образуя гидроксид аммония NH4OH:
NH3 + H2O = NH4OH = NH4+ + OH-,
Поэтому бесцветная фенолфталеиновая бумага окрашивается в малиновый цвет.
2. Реактив Несслера, т.е. раствор комплексной соли К2[HgJ4] в KOH образует с ионами NH4+ характерный красно-бурый (оранжевый) осадок иодида оксидимеркураммония:
N

 H4Cl
+ 2 K2[HgJ4]
+ 4KOH
=
H4Cl
+ 2 K2[HgJ4]
+ 4KOH
=
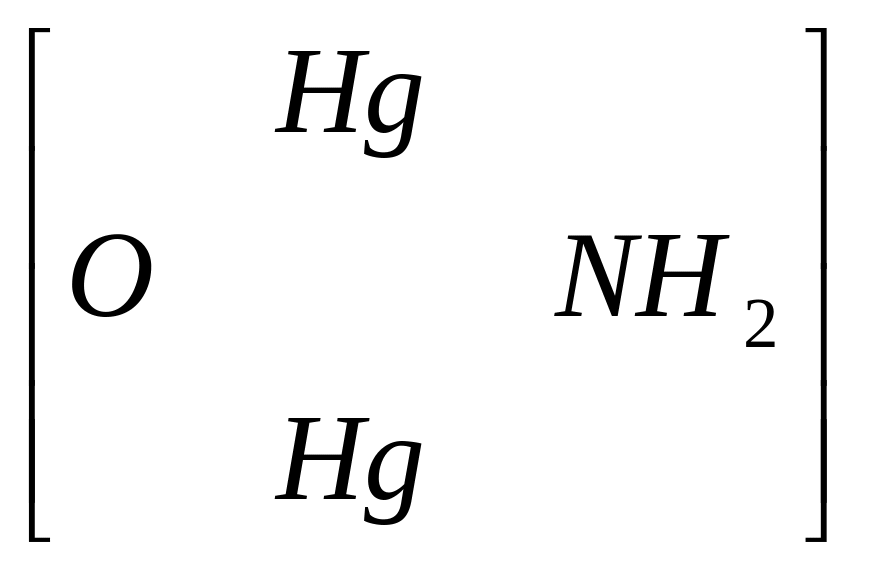 I↓
+ 3H2O
+ 7KI
+ KCl
I↓
+ 3H2O
+ 7KI
+ KCl
Выполнение реакции на предметном стекле. На предметное стекло наносят 1 каплю раствора соли аммония и 1-2 капли реактива Несслера (реактив берут в избытке по сравнению с количеством присутствующей соли аммония, так как в избытке соли аммония осадок растворим). Внешний эффект – появление красно-бурого осадка. Очень малые количества (следы) солей аммония вместо красно-бурого осадка дают желто-оранжевое окрашивание.
Реакции ионов магния
Реакции ионов Mg2+ сильно отличаются от реакций остальных катионов I группы.
1. Едкие щелочи образуют с Mg2+ белый аморфный осадок Mg(ОН)2 студенистого вида:
Mg2+ + 2OH- = Mg(OH)2↓
Мешают соли NH4+, так как вследствие гидролиза они уменьшают концентрацию ионов ОН- в растворе и осадок Mg(OH)2 выпадает неполно.
Выполнение реакции. К 2 каплям раствора соли Mg2+ прибавляют 2-3 капли 2н. NaOH. Внешний эффект – выпадение белого аморфного осадка Mg(OH)2.
2. Гидрофосфат натрия Na2НРО4 в присутствии NH4OH и NH4Cl образуют с Mg2+ белый кристаллический осадок двойной соли MgNH4PO4:
Mg2+ + HPO42- + NH4OH = MgNH4PO4↓+ H2O
Соль аммония прибавляют для того, чтобы при действии аммиака не образовался осадок Mg(OH)2.
Выполнять эту реакцию лучше в кислом растворе, постепенно понижая его кислотность прибавляемым по каплям NH4OH. Растворимость MgNH4PO4 при этом будет постепенно уменьшаться и тем самым будут созданы условия для медленной кристаллизации, способствующие образованию хорошего, явственно кристаллического осадка.
Выполнение реакции: В пробирку помещают 2-3 капли соли Mg2+, прибавляют 3-4 капли 2н. HCl, 2-3 капли раствора Na2HPO4 и 1 каплю фенолфталеина (для регулирования кислотности среды). Затем постепенно, по каплям, прибавляют NH4OH до появления не исчезающей розовой окраски раствора (рН = 9). Потереть стеклянной палочкой. Внешний эффект – выпадение белого кристаллического осадка MgNH4PO4.
3. Растворимые карбонаты образуют с Mg2+ белый аморфный осадок (MgOH)2CO3, малорастворимый в воде в отличие от Na2CO3, K2CO3 и (NH4)2CO3:
2Mg2+ + 2CO32- + H2O = (MgOH)2CO3↓+ CO2↑
Осадок растворим в солях NH4+, поэтому при действии группового реагента на II группу (NH4)2CO3 магний остается в растворе вместе с катионами I группы. Это дает основание отнести Mg2+ к I аналитической группе:
(MgOH)2CO3↓ + 4NH4+ + H2O = 2Mg2+ + 4NH4OH + CO2↑
Выполнение реакции: К 2-3 каплям раствора соли Mg2+ прибавляют 1-2 капли раствора Na2CO3. Внешний эффект – выпадение белого осадка (MgOH)2CO3. Прибавить 2-3 капли NH4Cl, наблюдать исчезновение осадка.
4. Оксихинолин C9H7ON в аммиачной среде (рН = 10-12) образует с ионами Mg2+ зеленовато-желтый кристаллический осадок внутрикомплексной соли оксихинолината магния Mg(C9H6ON)2. Реагент специфичен на соли магния, но не взаимодействует с катионами I,II групп. Используется для обнаружения ионов Mg2+ в дробном анализе.
Выполнение реакции: К 2-3 каплям раствора соли Mg2+ прибавляют 1 каплю фенолфталеина и по NH4OH до появления розоватого окрашивания. Смесь нагревают почти до каления и прибавляют 4-5 капель 5%-ного спиртового раствора оксихинолина. Внешний эффект – выпадение зеленовато-желтого кристаллического осадка оксихинолината магния.
Выполнение реакции с экстракцией (для повышения предела обнаружения). К 2-3 каплям раствора соли Mg2+ прибавляют по каплям раствор 2н. NH4OH до слабого запаха, 4-5 капель раствора оксихинолина и 1 мл. изоамилового спирта. Смесь встряхивают 30 с. и дают отстояться. Внешний эффект – верхний спиртовый слой окрашивается в зеленовато-желтый цвет вследствие экстракции оксихинолината магния.
