
3. Осмос і осмотичний тиск.
Здійснимо уявний дослід. Нехай в циліндрі під поршнем міститься розчин, який складається з розчинника і однієї розчиненої речовини, а над поршем – чистий розчинник (див. рис. 3).
Якщо розглядати розчинену речовини як газ, що перебуває у рівновазі при найбільшому об’ємі, то це означатиме, що розчинена речовина прямуватиме до збільшення об’єму. Але під час розширення молекули розчиненої речовини будуть тиснути на поршень. Величину цього тиску ми зможемо визначити лише тоді, коли поршень буде виготовлений з такого матеріалу, який вільно пропускає крізь себе розчинник і не пропускає розчиненої речовини. Речовина, яка задовольняє цій вимозі, називається напівпроникливою.
Тиск, спричинений розчиненою речовиною на напівпроникливу перепону, називається осмотичним тиском. За наявності цього тиску поршень буде підніматись в гору із проникненням розчинника з простору над поршнем у простір під поршнем. Процес проникнення розчинника крізь напівпроникливу перепону називається осмосом.
Продемонструвати
явище осмосу можна за допомогою такого
простого досліду. У целофановий мішечок
наллємо водного розчину цукру або солі
і прив’яжемо його до корка з отвором.
В отвір корка вставимо скляну трубку і
мішечок опустимо в посудину з чистою
водою. Незабаром розчин почне підійматися
в гору по трубці. Це свідчить про те, що
кількість розчину в мішечку збільшується.
Рівень розчину в трубці буде підійматись
доти, поки гідростатичний тиск стовпчика
розчину в трубці не зрівняється з
осмотичним тиском розчину. Коли розчин,
густина якого дорівнює
![]() ,
підніметься у трубці на висоту
,
підніметься у трубці на висоту
![]() ,
то осмотичний тиск дорівнюватиме
,
то осмотичний тиск дорівнюватиме
![]() .
В цьому досліді необхідно, щоб об’єм
мішечка був значно меншим від об’єму
посудини.
.
В цьому досліді необхідно, щоб об’єм
мішечка був значно меншим від об’єму
посудини.
Процес осмосу можна пояснити з допомогою досліду Квінке. На дно посудини помістимо сухий хлористий кальцій, поверх нього шар хлороформу, а далі буде шар води (рис. 5).

Хлористий кальцій у хлороформі не розчиняється, але розчиняється у воді. Вода в свою чергу слабо розчиняється у хлороформі. Та вода, яка розчиняється у хлороформі, вбирається хлористим кальцієм, і т.д. Це означає, що в досліді Квінке хлороформ наче відіграє роль насоса, який переганяє воду до хлористого кальцію. Подібне значення має і напівпрониклива перегородка, яка перетягає розчинник у розчин.
Д осліди
показують, що у випадку розчинів малих
концентрацій осмотичний тиск пропорційний
концентрації. При цьому добуток
осмотичного тиску на об’єм розчину
пропорційний абсолютній температурі.
осліди
показують, що у випадку розчинів малих
концентрацій осмотичний тиск пропорційний
концентрації. При цьому добуток
осмотичного тиску на об’єм розчину
пропорційний абсолютній температурі.
 .
(2)
.
(2)
Рівняння (2) - кількісний вираз закону Ван-Гоффа, який стверджує, що осмотичний тиск, створений розчиненою речовиною, дорівнює тому тиску, який би створювала ця сама речовина в газоподібному стані при тій же температурі і тому ж об’ємі. Його величина не залежить від природи розчинника і розчинної речовини, а тільки від молярної об’ємної концентрації остатньої. Осмотичний тиск має достатньо великі значення. Але стінки посудини не відчувають його. Осмотичний тиск діє також і на вільну поверхню рідини. Сили натягу, які виникають при цьому, компенсують осмотичний тиск. На стінки посудини діє лише гідростатичний тиск.
Для
ілюстрації наводимо дані Берклі і Хартлі
щодо визначення осмотичного тиску при
![]() для розчинів тростинного цукру і глюкози
в залежності від концентрації. З
підвищенням температури осмотичний
тиск пропорційно зростає.
для розчинів тростинного цукру і глюкози
в залежності від концентрації. З
підвищенням температури осмотичний
тиск пропорційно зростає.
Залежність
![]() від концентрації розчинів
від концентрації розчинів
-
Розчинені речовини
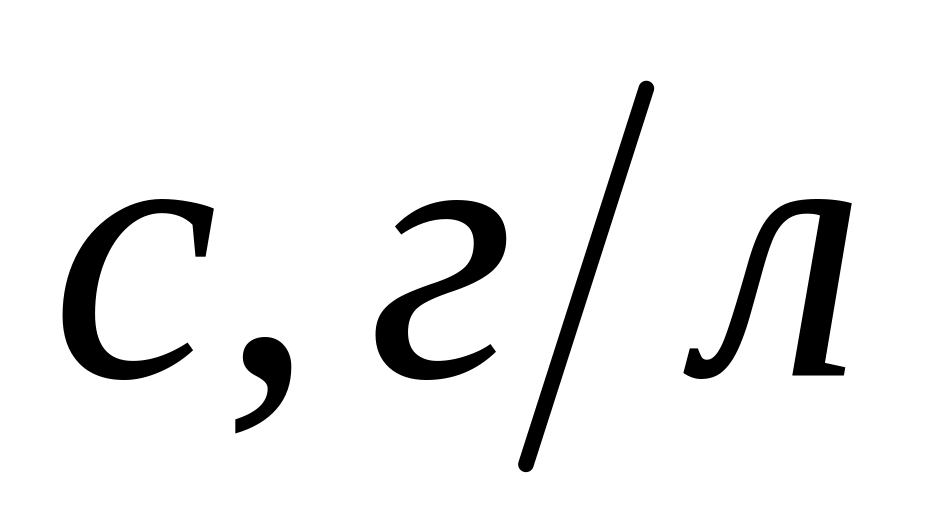

Тростинний цукор
2,02
10,0
20,0
45,0
93,75
169,3
34,2
17,1
7,6
3,65
0,134
0,66
1,32
2,97
6,18
Глюкоза
99,8
199,5
319,2
448,6
548,6
1,804
0,902
0,564
0,401
0,328
13,21
29,17
53,19
87,87
121,18
Осмос має велике значення в біології. Як відомо, кожна жива клітина дихає, живе, росте і розмножується. Речовини, необхідні для живлення і дихання клітини, надходять до неї з навколишнього повітря і ґрунту, а часто з сусідніх клітин. Надходження поживних речовин у клітину великою мірою залежить від клітинної оболонки і цитоплазми. Саме оболонка клітини відіграє роль напівпроникливої перегородки, а цитоплазма – роль розчину, тобто процес живлення зумовлений осмосом.
