
- •Неорганическая химия. Химия элементов
- •Глава 14
- •14.1. Общая характеристика
- •14.1.1 Положение в Периодической системе
- •14.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
- •14.1.3. Нахождение в природе, изотопный состав
- •14.1.4. Краткие исторические сведения
- •14.2. Простые вещества
- •14.2.1. Углерод
- •14.2.2. Кремний
- •14.2.3. Германий
- •14.2.4. Олово
- •14.2.5. Свинец
- •14.3. Сложные соединения элементов 14-й группы
- •14.3.1. Кислородные соединения
- •14.3.1.1. Оксиды
- •14.3.1.2. Гидраты оксидов и их соли
- •14.3.2. Галогениды
- •14.3.2.1. Галогениды углерода
- •14.3.2.2. Галогениды кремния
- •14.3.2.3. Галогениды германия
- •14.3.2.4. Галогениды олова
- •14.3.2.5. Галогениды свинца
- •14.3.3. Гидриды и их производные
- •14.3.3.1. Водородные соединения углерода и их производные
- •14.3.3.2. Гидриды кремния и их производные
- •14.3.3.3. Водород-кислородные соединения кремния
- •14.3.3.4. Гидриды элементов подгруппы германия
- •14:3.4 Азотсодержащие соединения
- •14.3.4.1. Соединения углерода с азотом
- •14.3.4.2. Соединения кремния с азотом
- •14.3.4.3. Соединения элементов подгруппы германия с азотом
- •14.3.5. Соединения с халькогенами
- •14.3.5.1. Соединения углерода с серой
- •14.3.5.2. Сульфиды кремния
- •14.3.5.3. Халькогениды элементов подгруппы германия
- •14.4. Комплексные соединения элементов 14-й группы
- •14.5. Металлоорганические и элементоорганические соединения элементов 14-й группы
- •14.6. Биологическая роль элементов 14-й группы
Ю.Д. Третьяков, Л.И. Мартыненко, А.Н. Григорьев, А.Ю. Цивадзе
Неорганическая химия. Химия элементов
Учебник для вузов: В 2 книгах. Книга II/. – М.: Химия, 2001.
Глава 14
14-Я ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ – УГЛЕРОД, КРЕМНИЙ, ПОДГРУППА ГЕРМАНИЯ
14.1. Общая характеристика
14.1.1 Положение в Периодической системе
В 14-ю группу ПС входят типические (по Менделееву) элементы углерод 6С и кремний 14Si, а также элементы подгруппы германия - германий 32Gе, олово 50Sn, свинец 82Рb. Углерод - один из самых важных элементов, ведь его соединения определяют возможность биологической жизни на Земле. Кремний играет столь же важную роль в неорганической природе. В табл. 14.1 представлены важнейшие характеристики элементов 14-й группы.
14.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
Все элементы 14-й группы, будучи электронными аналогами, содержат валентные электроны на ns2- и np2-подуровнях, т.е. принадлежат к числу p-элементов (табл. 14.1). У типических элементов - углерода и кремния - валентным электронам предшествует замкнутая электронная оболочка типа благородного газа (1s2 у углерода и 2s22p6 у кремния). Элементы подгруппы германия на предвнешней оболочке содержат 18 электронов, т. е. относятся к постпереходным элементам. Лантанидное сжатие заметным образом не влияет на ход изменения радиусов атомов и ионов олова и свинца, а также на значения ПИ. В 14-й группе значения радиусов и ПИ изменяются достаточно равномерно: между лантанидами и свинцом в шестом периоде находятся 10 элементов, т.е. эти элементы далеко отстоят друг от друга. Как и в других группах ПС, содержащих постпереходные элементы, сверху вниз по группе возрастает устойчивость соединений элементов в низшей (+2) степени окисления и, напротив, убывает устойчивость соединений элементов в степени окисления +4. Это связано с легкой деформируемостью электронных оболочек постпереходных элементов и с возрастанием в ряду С - Рb различий в энергии взаимодействия «остова» атома с валентными электронами, находящимися на ns- и на nр- подуровнях.
Влияние на стабильность соединений элементов подгруппы Ge в высшей степени окисления +4 эффекта дополнительной поляризации подтверждается тем, что значения потенциалов ионизации (ПИ1 - ПИ4, табл. 14.1) в ряду Ge-Pb изменяются мало, тогда как значения электроотрицательности от Ge к Рb существенно возрастают. Следовательно, на устойчивость соединений типа ЭО2, ЭХ4 и т. д. оказывает влияние не особая трудность отрыва 6s-электронов от атома Э0, а перераспределение электронной плотности между атомами-партнерами при образовании таких соединений.
Углерод, возглавляющий 14-ю группу, - особый элемент ПС. Благодаря удачному сочетанию присущих ему размеров атома и строения электронной оболочки, углерод способен образовывать разнообразнейшие по составу, свойствам и строению соединения (так называемые органические соединения), роль которых в природе необыкновенно велика. Без углерода жизнь на Земле не могла бы существовать.
Электронная оболочка невозбужденного атома углерода имеет строение 1s22s22p2. Вступая в химические реакции, углерод «распаривает» электронный дублет 2s2, в результате на энергетическом уровне с главным квантовым числом n = 2 у углерода появляются четыре неспаренных электрона. Распределение электронов по энергетическим ячейкам (в терминах МВС) показано на схеме:

Таблица 14.1. Важнейшие характеристики элементов 14-й группы
Элемент |
Ar |
Электронная конфигурация изолированного атома* |
Радиус, Å |
Потенциал ионизации, эВ |
ЭО |
Степень окисления |
||||||
Э0 |
Э2+ (КЧ = 6) |
Э4+ |
ПИ1 |
ПИ2 |
ПИ3 |
ПИ4 |
||||||
(КЧ = 4) |
(КЧ = 8) |
|||||||||||
6С |
12,011 |
1s22s22p2 |
0,77 (ковал.) |
|
0,15 |
0,16 |
11,26 |
24,38 |
47,93 |
64,49 |
2,50 |
-4, 0, +2, +4 |
14Si |
28,0855 |
2s22p63s23p2 |
1,17 (ковал.) |
|
0,26 |
0,40 |
8,15 |
16,35 |
33,49 |
45,14 |
1,74 |
-4, 0, (+2), +4 |
32Ge |
72,61 |
3s23p63d104s24p2 |
1,22 (ковал.) 1,39 (металл.) |
0,73 |
0,39 |
0,53 |
7,90 |
15,93 |
34,22 |
45,71 |
2,02 |
0, (+2), +4 |
50Sn |
118,710 |
4s24p64d105s25p2 |
1,40 (ковал.) 1,58 (металл.) |
1,18 |
0,55 |
0,69 0,81 (КЧ = 8) |
7,34 |
14,63 |
30,50 |
40,73 |
1,72 |
0, +2, +4 |
82Pb |
207,2 |
4d104f145s25p65d106s26p2 |
1,46 (ковал.) 1,74 (металл.) |
1,19 0,98 (КЧ = 4) 1,29 (КЧ = 8) |
0,65 |
0,77
0,94 (КЧ = 8) |
7,42 |
15,03 |
31,94 |
42,32 |
1,55 |
0, +2, (+4) |
* См. примечание к табл. 11.1.
В условиях sp3-гибридизации становится возможным образование углеродом четырех равноценных ковалентных связей, тетраэдр и чески направленных в пространстве. Хотя такая же возможность в принципе имеется и у тяжелых электронных аналогов углерода, все же его состояние в этом отношении уникально. Благодаря малым размерам атома (см. табл. 14.1), он способен создавать одномерные, двумерные и трехмерные образования из атомов углерода, связанных друг с другом в бесконечные цепочки. Все другие элементы ПС не могут образовывать такие длинные и прочные цепочки, а поэтому их соединения не так многообразны, как у углерода.
Практически во всех гомо- и гетероатомных соединениях углерода осуществляется ковалентная связь. Атомы углерода в них не несут сколько-нибудь значительного положительного или отрицательного заряда, хотя им приписывают степени окисления от -4 (например, в метане СН4) до +4 (в углекислом газе). Действительно, рассчитанный радиус иона С4+ слишком мал (0,15 Ǻ), а иона С4- слишком велик (2,60 Ǻ), чтобы такие частицы могли быть стабильными в обычных химических условиях. Примером соединений углерода, в которых его атомы все же имеют некоторый положительный заряд, может быть четыреххлористый углерод (тетрахлорид углерода). Так как углерод более электроположителен, чем хлор, электронная плотность в ССl4 смещена от углерода к атомам хлора:
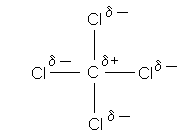
Напротив, в карбидах - соединениях углерода с элементами-металлами - электронная плотность практически полностью смещена в сторону атома углерода: например, структура карбида кальция СаС2 состоит из ионов С2– и Са2+.
В связи с преобладающе ковалентным характером большинства гетероатомных соединений углерода они имеют молекулярную структуру и поэтому характеризуются сравнительно низкими значениями ТПЛ, и ТКИП. Например, ТКИП CCl4 = 76,6, TКИП СH4 = -161, TКИП СH3Cl = –240C.Однако среди углеродсодержащих соединений есть и тугоплавкие, практически нелетучие вещества с атомной ковалентной связью (например, простое вещество - углерод), а также соединения с металлической связью (карбиды переходных элементов-металлов).
Аналогично углероду, устойчивое валентное состояние кремния достигается при образовании четырех ковалентных равноценных связей: происходит sp3-гибридизация орбиталей. При этом валентные электроны атома кремния переходят в возбужденное состояние: 1s22s22p63s13px3py3pz. Ввиду относительной близости энергии 3s- и 3p-уровней для «распаривания» электронной пары 3s2 требуется затрата 397 кДж/моль, т. е. почти такая же, как в случае углерода (401 кДж/моль).
Степень окисления кремния в его соединениях изменяется от +4 (например, в SiO2 и силикатах) до -4 (например, в силицидах типа Mg2Si). Как и в соединениях углерода, в кремнийсодержащих веществах нет ионов Si4+ и Si4– (с радиусом соответственно 0,26 и 2,50 Ǻ), поскольку в них всегда сосуществуют электростатическое и ковалентное взаимодействия. У кремния при главном квантовом числе n = 3, в отличие от углерода, имеются незаполненные 3d-орбитали, которые могут использоваться в некоторых его соединениях для образования более чем четырех связей. Однако в такого рода соединениях кремния, например, в H2[SiF6], при образовании ковалентных связей обычно задействовано не более двух 3d-орбиталей, и его КЧ поэтому не превышает шести (sp3d2-гибридизация). 3d-Орбитали кремния принимают участие в образовании -связей (d-р-связывание) и дополнительных -связей с наиболее электроотрицательными элементами (например, с фтором в ионе [SiF6]2-). При этом происходит донорно-акцепторное взаимодействие с размещением неподеленных электронных пар ионов F– на гибридизованных орбиталях кремния. В образовании этих связей наиболее вероятно участие dz2- и dx2-y2-орбиталей, которые направлены вдоль тех же осей х, у, z, что и p-орбитали ионов фтора. При взаимодействии с менее электроотрицательными элементами, чем фтор, вклад d-орбиталей в образование связей меньше. Поэтому, как правило, в кислородных соединениях и всегда в соединениях с водородом, хлором, бромом и иодом КЧ кремния равно 4, и только в соединениях с фтором достигает 6.
Из-за большего радиуса атома электроотрицательность кремния меньше, чем у углерода (см. табл. 14.1). Это одна из причин существенно большего вклада ионных сил в образование гетероатомных соединений кремния. Например, доля ионности и ковалентности в самом известном соединении кремния - кремнеземе SiO2 - равна 50%. К тому же больший, чем у углерода, радиус атома приводит к ослаблению ковалентных связей и в гетеро-, и в гомоатомных соединениях кремния из-за уменьшения перекрывания орбиталей взаимодействующих атомов. Поэтому химия кремния и углерода существенно различается.
Элементы подгруппы Ge, имеющие легко деформируемую предвнешнюю 18-электронную оболочку, характерную для всех постпереходных элементов, отличаются от легких аналогов - С и Si, у которых электронам валентности предшествует «жесткая» 8-электронная оболочка.
Наличие 18-электронной, а у Рb - перед ней еще и 32-электронной легко деформирующейся предвнешней оболочки приводит к образованию элементами подгруппы германия химических связей, более ковалентных, чем в таких же по стехиометрии соединениях, образованных элементами, не имеющими такого электронного строения, например, элементами группы титана (4-я группа ПС). Следствием дополнительного эффекта поляризации, особенно сильно выраженного у соединений Рb, является понижение стабильности соединений с высшей степенью окисления +4 и, напротив, повышение устойчивости соединений с низшей степенью окисления +2 по ряду Ge - Рb.
В группе титана наблюдается противоположная тенденция - повышение стабильности соединений со степенью окисления +4 происходит как раз у тяжелых элементов. Такая закономерность характерна для ПС в целом и может быть объяснена различным ходом изменения поляризующего действия в группах, содержащих элементы с 8- и 18-электронными предвнешними оболочками.
Следует отметить, что значения радиуса атомов или ионов (для той или иной степени окисления) у элементов группы Ti и подгруппы Ge в целом не слишком сильно различаются, например радиусы атомов в металле:
Элемент |
Радиус атома в металле, Å |
Элемент |
Радиус атома в металле, Å |
Ti |
1,45 |
Ge |
1,39 |
Zr |
1,60 |
Sn |
1,58 |
Hf |
1,59 |
Pb |
1,74 |
Это связано с тем, что при заполнении электронами d-подуровня в данном периоде с ростом общего числа электронов радиус атома сначала несколько уменьшается, а потом лишь слабо растет:
Элемент |
К |
Са |
Ti |
Fe |
Cu |
Zn |
Ge |
r, Ǻ |
2,36 |
1,97 |
1,45 |
1,27 |
1,28 |
1,33 |
1,39 |
В приведенном здесь выборочном ряду элементов «металлический» радиус сильно уменьшается только при переходе от ЩЭ и ЩЗЭ к титану, а от Ti до Ge, несмотря на существенное возрастание атомного номера (22Ti, 32Gе), радиус убывает только на 0,06 Ǻ. Это связано с ростом притяжения наружных электронов (при постоянном значении главного квантового числа) атомным ядром, заряд которого увеличивается при переходе от титана к германию на 10 единиц.
Таким образом, на стабильность валентных состояний влияет, прежде всего, не значение атомного (или ионного) радиуса, а строение электронной оболочки. В то же время переход из одного валентного состояния в другое сопровождается более существенным изменением размера частиц, чем перемещение по периоду и группе (при сохранении постоянного валентного состояния).
Например, для свинца переход от степени окисления 0 до +4 приводит к изменению радиуса частицы почти на 1 Ǻ:
Pb0 |
|
PbII |
|
PblV |
1,74 Ǻ |
|
1,19 Ǻ |
|
0,77 Ǻ |
Надо учесть, однако, что определение радиуса иона Рb4+ не может быть точным из-за очень сильного поляризующего действия свинца, обусловливающего наложение ковалентной связи на ионную как в соединениях PbII, так и в особенности в производных PbIV. Результатом сильного поляризационного взаимодействия, развивающегося под воздействием свинца (IV) на бромид- и иодид-ионы, является нестабильность РbВr4 и Рb4. Причина обсуждалась при рассмотрении химии галогенидов меди(II) (см. разд. 11.3.2.2).
Малую вероятность существования соединений элементов подгруппы германия в степени окисления +4 с ионным типом связи доказывают значения потенциалов ионизации Ge – Sn - Pb (см. табл. 14.1): значения ПИ3 и ПИ4 столь велики, что становится очевидной невозможность реализации ионного состояния Э4+ в обычных химических условиях.
Типичные гомо- и гетероатомные соединения элементов 14-й группы представлены в табл. 14.2.
Таблица 14.2. Основные типы химических соединений элементов 14-й группы
Класс соединений |
Формула |
Элемент, образующий соединение |
Характерные свойства |
Простые вещества |
Э |
С |
Неметалл, изолятор(алмаз), квазиметалл (графит) |
Si, Ge, -Sn |
Неметаллы, полупроводники |
||
(Ge), Sn, Pb |
Металлы, проводники |
||
Оксиды |
ЭО2 (диоксид) |
С - Pb |
Структура изменяется от молекулярной к ионной (С - Pb), кислотно-основные свойства - от кислотных к амфотерным, окислительные свойства максимальны у РbО2 |
ЭО (монооксид) |
С, Si |
Молекулярная структура, газы |
|
Гидраты оксидов |
Кислоты |
|
Кислотные свойства убывают от С к Ge и Sn |
Н2ЭО3 |
С, Si |
||
(Н4ЭО4)n |
Si |
||
ЭО2nН2О |
Si, Ge, Sn |
||
Основания |
|
Основные свойства усили- ваются у гидроксидов Pb |
|
Э(ОН)2 |
Sn, Pb |
||
Э(ОН)4 |
|||
Соли, содержащие ЭIV в оксоанионе |
(ЩЭ)2ЭО3 (карбонаты, силикаты), (ЩЭ)НЭО3 (гидрокарбонаты), (ЩЭ)2ЭО3nЭО2 (полисиликаты, полигерманаты) |
С, Si, Ge |
Сильный гидролиз из-за слабо выраженных кислотных свойств, отсутствие окислительных свойств |
Соли, содержащие ЭII в катионе |
ЭХ2 (галогениды, нитраты, ацетаты – безводные и гидратированные) ЭSO4, ЭСО3 |
Pb, Sn, Ge |
Убывание восстановительных свойств и уменьшение гидролиза от Ge к Pb |
Безводные галогениды |
ЭIIХ2, ЭIVX4 |
С, Si, Ge, Sn, Pb |
Возрастание окислительных свойств к Pb |
Соли или смешанные оксиды, полученные твердофазным методом |
(ЩЭ)2ЭIVО3, х(ЩЭ)2ОyЭIVO2, х(ЩЗЭ)ОуЭIVO2 (карбонаты, полисили- каты, полигерманаты, полистаннаты) |
С, Si, Ge, (Sn) |
Тугоплавкие, нерастворимые соединения |
Гидриды |
ЭН4, ЭnН2n+2, ЭnН2n, и др. (углеводороды, силаны, германы, станнан, плюмбан) |
С, Si, Ge.Sn, (Pb) |
Уменьшение длины цепи а также термодинамической и термической стабильности от С к Pb |
Нитриды, карбиды, сульфиды, силициды, фосфиды |
ЭN, ЭxСy, ЭS2, ЭxSiy ЭxРy |
С, Si, Ge. Sn, Pb |
Многие бинарные соединения имеют практическое значение (тугоплавкость или, наоборот, летучесть, химическая инертность или, наоборот, высокая реакционная способность) |
КС с Э|V в лиганде |
Комплексные карбонаты [МII(ЭО3)2]2–, [МIII(ЭО3)3]3–, [MIV(ЭO3)4]4– |
С |
Растворимые комплексные карбонаты многозарядных катионов (Be, U, Th) используются в химической технологии |
КС катионов Эn+ с моно- и полиден-татными углерод-содержащими лигандами, в том числе с СО (карбонилы) |
[ЭL] [ЭL2] [ЭL3] [ЭL4] |
Ge - Pb |
Широкий спектр свойств (растворимость, летучесть, устойчивость, инертность и т.д.) |
МОС, ЭОС |
RnЭ, RmЭX |
Si, Ge, Sn, Pb |
Содержат связь Э-С, имеют практическое значение |
