
- •Республики беларусь Высшее учебное учреждение «Командно-инженерный институт»
- •Методические указания к решению задач и контрольные задания по разделу «Процессы горения. Опасные факторы пожара»
- •Введение
- •Общие методические указания
- •Рекомендуемый порядок действий при решении задач
- •Примеры решения задач
- •1. Материальный баланс процессов горения
- •1.1. Расчет количества воздуха, необходимого для горения веществ Расчетные формулы
- •Примеры
- •Объем воздуха, израсходованного на горение 1 м3 аммиака, определим по формуле (1.7):
- •1.2. Расчет объема и состава продуктов горения Расчетные формулы
- •Здесь – теоретический объем продуктов горения;
- •Состав продуктов горения, т.Е. Содержание I-го компонента (% об.), определяется по формуле:
- •Примеры
- •2. Тепловой баланс процессов горения
- •2.1. Расчет теплоты сгорания веществ Расчетные формулы
- •Примеры
- •2.2. Расчет температуры горения
- •Примеры
- •6 Моль, 3 моля, 26,32 моля, ,
- •Концентрационные пределы воспламенения
- •Примеры
- •4. Температурные параметры пожарной опасности веществ
- •4.1 Расчет температурных пределов воспламенения
- •Примеры.
- •4.2. Расчет температур вспышки и воспламенения
- •Примеры
- •4.3. Расчет температуры самовоспламенения
- •Расчет температуры потухания
- •Примеры
- •4.5. Температура и давление взрыва при взрыве паровоздушных смесей
- •Примеры
- •Перечень контрольных задач
- •Приложение
- •Энтальпия (теплосодержание) газов при постоянном давлении
- •Энтальпия (теплосодержание) газов при постоянном давлении
- •Теплота образования и сгорания некоторых веществ
- •Показатели пожарной опасности некоторых газов
- •Показатели пожарной опасности некоторых жидкостей
- •Величины параметров k и l для вычисления
- •Давление насыщенных паров некоторых веществ, гПа
- •Продолжение таблицы 7
- •Температура самовоспламенения (к) некоторых предельных углеводородов
- •Температура самовоспламенения (к) некоторых предельных одноатомных спиртов в зависимости от средней длины углеродной цепи
- •Значение параметров для расчета минимальной флегматизирующей
- •Внутренняя энергия газов
- •Литература
- •Содержание
Примеры
Пример 1. По предельной теплоте сгорания определить нижний концентрационный предел воспламенения бутана в воздухе.
Решение.
Для расчета по формуле (3.1) в табл. 3 приложения находим низшую теплоту сгорания вещества. В данном случае она составляет 2882,3 кДж/моль. Эту величину переводим в кДж/м3:
![]()
По формуле (3.1) определим НКПВ:
![]()
По
табл. 4 приложения находим, что
экспериментальное значение
![]() Относительная ошибка расчета,
следовательно, составляет:
Относительная ошибка расчета,
следовательно, составляет:
![]()
Пример 2. Определить концентрационные пределы воспламенения этилена в воздухе.
Решение.
Расчет КПВ проводим по аппроксимационной формуле. Определим значение стехиометрического коэффициента при кислороде:
C2H4 + 3O2 = 2CO2 + 2H2O.
Таким образом, n=3. Тогда имеем:
![]()
![]()
Определим относительную ошибку расчета. По табл. 4 приложения находим, что экспериментальные значения КПВ равны 3,0 – 32,0. Тогда имеем:
![]()
![]() ;
;
Следовательно, при расчете НКПВ этилена результат завышен на 8 %, а при расчете ВКПВ – занижен на 40 %.
Пример 3. Определить концентрационные пределы воспламенения насыщенных паров метанола в воздухе, если известно, что его температурные пределы равны 280312 К. Атмосферное давление – нормальное.
Решение.
Для расчета по формуле 3.3 необходимо определить давления насыщенных паров, соответствующие нижнему (280 К) и верхнему (312 К) температурным пределам воспламенения.
По табл. 7 приложения находим, что давление насыщенного пара метанола на нижнем температурном пределе воспламенения находится между 53,3 и 80,0 гПа. Так как ближайшие к НТПВ температуры в таблице равны 278 и 285,1 К, линейной интерполяцией находим давление, соответствующее нижнему температурному пределу (280 К):
![]() гПа.
гПа.
Давление насыщенного пара метанола, соответствующее верхнему пределу, находится между 266,6 и 533,3 гПа:
![]() гПа.
гПа.
По формуле (3.3) определим КПВ:
![]()
![]()
Экспериментальные значения КПВ метанола равны 6,0-34,7 % (табл. 5 приложения). Относительная ошибка расчета составляет:
![]()
![]()
Следовательно, результаты расчета ВКПВ по известному значению ВТПВ занижены на 3,1 %. Это, вероятно, связано с ошибкой определения давления насыщенного пара методом интерполяции.
Пример 4. Определить концентрационные пределы воспламенения газовой смеси состава: 40 % пропана, 50 % бутана и 10 % пропилена.
Решение.
Для расчета КПВ смеси газов по формуле Ле-Шателье (3.4) необходимо определить КПВ индивидуальных горючих веществ, методы расчета которых рассмотрены выше:
С3Н8 – 2,1-9,5 %; С4Н10 – 1,9-9,1 %;С3Н6 – 2,2-10,3 %;
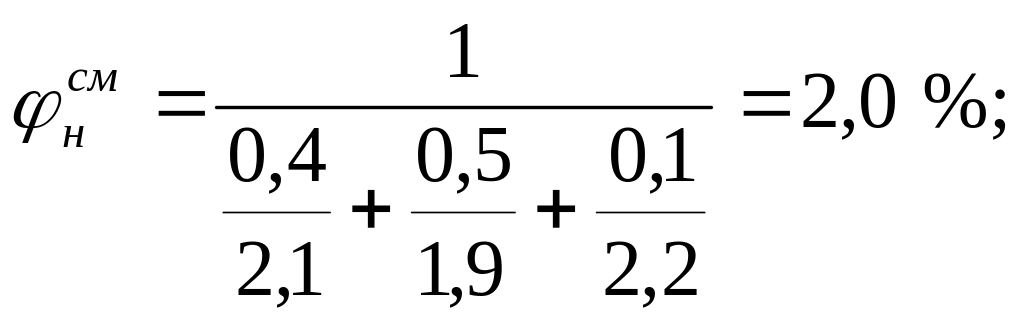
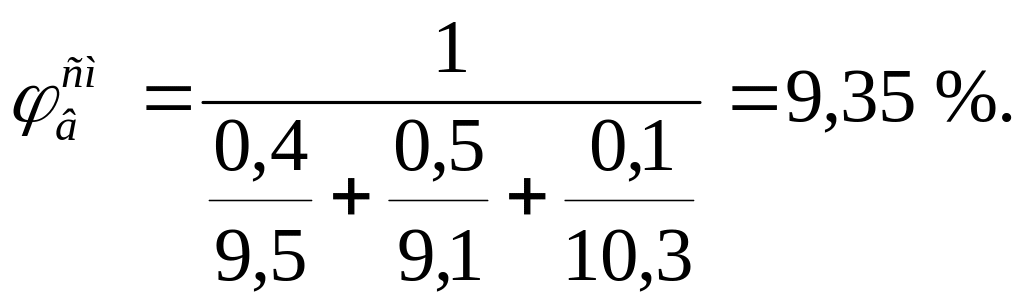
Пример 5. Определить минимальное количество диэтилового эфира (в кг), способное при испарении в емкости объемом 350 м3 создать взрывоопасную концентрацию.
Решение.
Концентрация
будет взрывоопасной, если
![]() (
(![]() концентрация паров горючего вещества).
концентрация паров горючего вещества).
Расчетом (см. примеры 1-3) или по табл. 5 приложения находим НКПВ диэтилового эфира, который равен 1,7 %.
Определим объем паров диэтилового эфира, необходимый для создания в объеме 350 м3 этой концентрации:
![]()
Таким образом, для создания НКПВ диэтилового эфира в объеме 350 м3 необходимо 5,95 м3 его паров. Принимая во внимание, что 1 кмоль (74 кг) газа, приведенный к нормальным условиям, занимает объем равный 22,4 м3, находим количество диэтилового эфира:
![]()
Пример 6. Определить, возможно ли образование взрывоопасной концентрации в объеме 50 м3 при испарении 5 кг гексана, если температура окружающей среды 300 К.
Решение.
Очевидно,
что паровоздушная смесь будет
взрывоопасной, если
![]() При 300 К объем паров гексана, образующийся
в результате испарения 5 кг вещества,
найдем, принимая во внимание, что при
испарении 1 кмоля (86 кг) гексана при
температуре 273 К объем паровой фазы
будет равен 22,4 м3:
При 300 К объем паров гексана, образующийся
в результате испарения 5 кг вещества,
найдем, принимая во внимание, что при
испарении 1 кмоля (86 кг) гексана при
температуре 273 К объем паровой фазы
будет равен 22,4 м3:
![]()
Концентрация паров гексана в помещении объемом 50 м3, следовательно, будет составлять:
![]()
Определив концентрационные пределы воспламенения гексана в воздухе (1,2-7,5%), видим, что образующаяся смесь является взрывоопасной.
Пример 7. Определить, образуется ли взрывоопасная концентрация насыщенных паров над поверхностью резервуара, содержащего 60 % диэтилового эфира и 40 % этилового спирта при температуре 245 К.
Решение.
Концентрация
паров будет взрывоопасной, если
![]() (
(![]() концентрация насыщенных паров смеси).
концентрация насыщенных паров смеси).
Очевидно, что в результате различной летучести веществ состав газовой смеси будет отличаться от жидкой. Содержание компонентов в газовой фазе по известному составу жидкой определим по закону Рауля для идеальных жидкостей.
Определим мольный состав жидкой фазы:
![]()
где
![]() –
мольная доля i-го
вещества;
–
мольная доля i-го
вещества;
qi – массовая доля i-го вещества;
Мi- молекулярная масса i-го вещества (Мдэ=74, Мэс=46).
![]()
![]()
По табл. 7 приложения методом линейной интерполяции определим давление насыщенного пара при 245 К над индивидуальными жидкостями:
![]() гПа;
гПа;
![]() гПа.
гПа.
Согласно закону Рауля парциальное давление насыщенных паров i-й жидкости над смесью равно произведению насыщенного пара над чистой жидкостью на ее мольную долю в жидкой фазе:
![]() гПа;
гПа; ![]() гПа.
гПа.
Приняв сумму давлений насыщенных паров диэтилового эфира и этилового спирта (25,58+1,2) равной 100 %, определим:
а) концентрацию паров в воздухе:
![]()
б) мольный состав газовой фазы (закон Рауля-Дуартье):
![]()
![]()
На основании КПВ индивидуальных веществ (диэтиловый эфир 1,7-49 %, этиловый спирт - 3,6-19 %) по формуле Ле-Шателье рассчитаем КПВ паровой фазы:
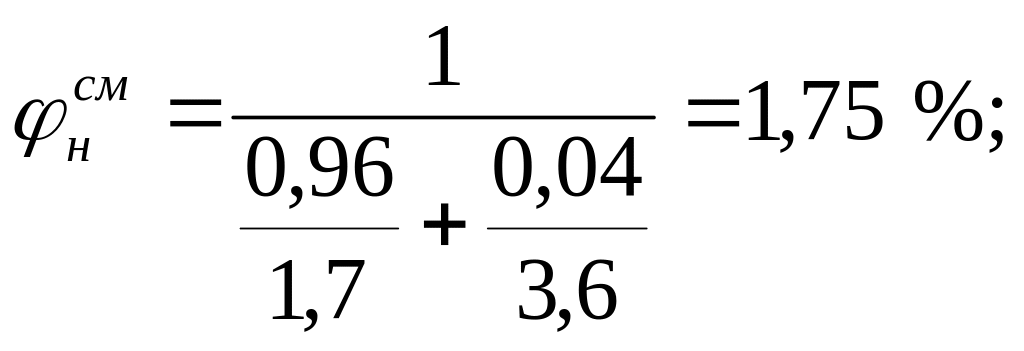
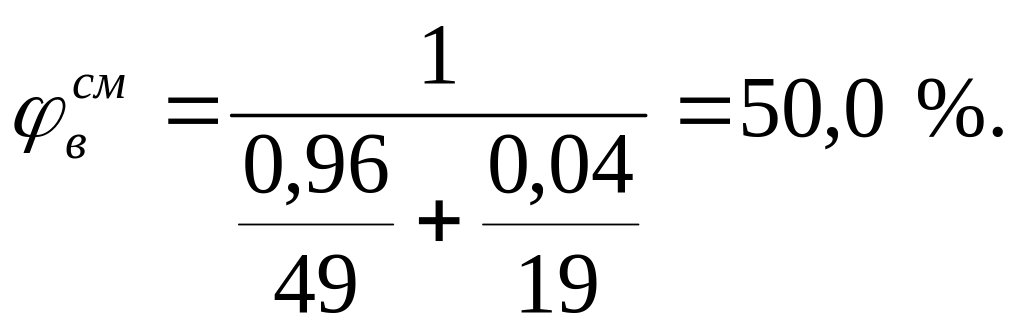
Сравнивая полученную концентрацию паровоздушной смеси с КПВ, делаем заключение, что при 245 К над данной жидкой фазой образуется взрывоопасная концентрация насыщенных паров.
